题目内容
下列实验操作或方法合理的是( )
| A、用加热NH4Cl的方法制氨气 |
| B、将CuSO4?5H2O置于蒸发皿中加热除去结晶水 |
| C、用金属钠检验酒精中是否含有水 |
| D、用饱和FeCl3溶液和沸水反应制备Fe(OH)3胶体 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.氯化铵分解生成氨气和HCl,氨气和HCl又极易化合生成氯化铵;
B.蒸发皿中加热后硫酸铜吸收水;
C.Na与酒精、水均反应生成氢气;
D.铁离子水解生成胶体.
B.蒸发皿中加热后硫酸铜吸收水;
C.Na与酒精、水均反应生成氢气;
D.铁离子水解生成胶体.
解答:
解:A.氯化铵分解生成氨气和HCl,氨气和HCl又极易化合生成氯化铵,则不能用加热NH4Cl的方法制氨气,故A错误;
B.蒸发皿中加热后硫酸铜吸收水,不能除去结晶水,应将CuSO4?5H2O置于坩埚中加热除去结晶水,故B错误;
C.Na与酒精、水均反应生成氢气,则不能用金属钠检验酒精中是否含有水,应利用无水硫酸铜检验,故C错误;
D.铁离子水解,加热促进水解,则能用饱和FeCl3溶液和沸水反应制备Fe(OH)3胶体,故D正确;
故选D.
B.蒸发皿中加热后硫酸铜吸收水,不能除去结晶水,应将CuSO4?5H2O置于坩埚中加热除去结晶水,故B错误;
C.Na与酒精、水均反应生成氢气,则不能用金属钠检验酒精中是否含有水,应利用无水硫酸铜检验,故C错误;
D.铁离子水解,加热促进水解,则能用饱和FeCl3溶液和沸水反应制备Fe(OH)3胶体,故D正确;
故选D.
点评:本题考查化学实验方案的评价,为高频考点,涉及气体的制备、物质的除杂和检验、胶体制备等,侧重物质性质及实验技能的考查,注意实验的评价性、操作性分析,题目难度不大.

练习册系列答案
相关题目
食盐主要成分是NaCl,还含有SO42-等其他可溶性杂质离子.下列说法不正确的是( )
| A、除去SO42-最合适的试剂是BaCl2 |
| B、工业上通过电解氯化钠溶液制备金属钠和氯气 |
| C、室温下,AgCl在水中的溶解度大于在食盐水中的溶解度 |
| D、用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液 |
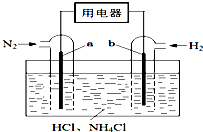 使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如右图所示.下列有关分析正确的是( )
使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如右图所示.下列有关分析正确的是( )| A、a为电池的负极 |
| B、通入N2一极的电极反应式为:N2+6e-+8H+═2NH4+ |
| C、电池工作一段时间后,溶液pH减小 |
| D、电流的方向是由b经用电器到a |
下列有关物质水解的说法正确的是( )
| A、蛋白质水解的最终产物是多肽 |
| B、淀粉水解的最终产物是葡萄糖 |
| C、纤维素不能水解成葡萄糖 |
| D、油脂水解产物之一是甘油 |
己知:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-25kJ?mol-1.某温度下的平衡常数为400.此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如表,下列说法中不正确的是( )
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol?L-1) | 0.08 | 1.6 | 1.6 |
| A、此时刻反应达到平衡状态 |
| B、容器内压强不变时,说明反应达平衡状态 |
| C、平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变 |
| D、平衡时,反应混合物的总能量降低40kJ |
形成物质世界多样性的原因有( )
①元素种类;②同位素;③成键方式;④同素异形现象;⑤反应现象.
①元素种类;②同位素;③成键方式;④同素异形现象;⑤反应现象.
| A、①③④⑤ | B、①②④⑤ |
| C、①②③④ | D、①②③④⑤ |
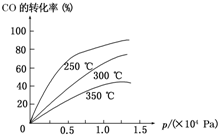 工业上一般在密闭容器中采用下列反应合成甲醇:
工业上一般在密闭容器中采用下列反应合成甲醇: