题目内容
11.工业上由钛铁矿(主要成分FeTiO3,含Fe2O3、A12O3、FeO、SiO2等杂质)制备TiCl4的工艺流程如图: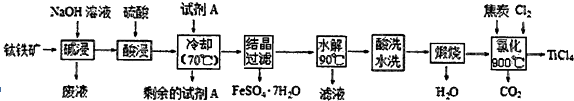
已知:①酸浸 FeTiO3(s)+2H2SO4(aq)═FeSO4(aq)+TiOSO4(sq)+2H2O(l)
②水解 TiOSO4(aq)+2H2O(l)$\frac{\underline{\;90℃\;}}{\;}$H2TiO3(s)+H2SO4(aq)
③煅烧 H2TiO3(s)$\frac{\underline{\;煅烧\;}}{\;}$TiO2(s)+H2O(g)
(1)FeTiO3中钛元素的化合价为+4,试剂A为Fe.
(2)碱浸过程发生的离子反应方程式为Al2O3+2OH-═2AlO2-+H2O;SiO2+2OH-═SiO32-+H2O.
(3)酸浸后需将溶液温度冷却至70℃左右,若温度过高会导致最终产品收率过低,原因是温度过高水导致TiOSO4提前水解生成H2TiO3沉淀.
(4)上述流程中氯化过程的化学反应方程式为TiO2+C+2Cl2$\frac{\underline{\;900℃\;}}{\;}$TiCl4 +CO2.
已知TiO2(s)+2Cl2(g)?TiCl4(1)+O2(g)△H=+15l kJ•mol-1.该反应极难进行,当向反应体系中加入碳后,则反应在高温条件下能顺利发生.从化学平衡的角度解释原因是C与氧气反应减小氧气浓度,使平衡正向移动,C与氧气反应为放热反应,温度升高,使平衡正向移动,促使反应顺利进行.
(5)TiCl4极易水解,利用此性质可制备纳米级TiO2•xH2O,该反应的化学方程式是TiCl4+(x+2)H2O=TiO2•xH2O+4HCl.
分析 钛铁矿用氢氧化钠溶液溶解,氧化铝、二氧化硅反应溶解,过滤得到钛铁矿精矿中主要含有FeTiO3、Fe2O3、FeO,再用浓硫酸处理,得到强酸性溶液中含有TiOSO4、Fe2(SO4)3、FeSO4及未反应的硫酸等,加入试剂A后冷却、结晶、过滤得到硫酸亚铁晶体,则A为Fe,将Fe3+转化为Fe2+.滤液进行水解得到H2TiO3,用硫酸洗去杂化,再煅烧得到TiO2,TiO2、C、Cl2反应得到TiCl4及CO2.
(1)反应①为非氧化还原反应,结合化合价代数和为0计算;
(2)氧化铝与氢氧化钠反应生成偏铝酸钠与水,二氧化硅与氢氧化钠反应生成硅酸钠与水;
(3)温度过高水导致TiO2+水解;
(4)氯化过程是TiO2、C、Cl2反应得到TiCl4及CO2;
C与氧气反应降低氧气浓度,C与氧气反应为放热反应,有利于平衡正向移动;
(5)TiCl4极易水解得到TiO2•xH2O,还生成HCl.
解答 解:钛铁矿用氢氧化钠溶液溶解,氧化铝、二氧化硅反应溶解,过滤得到钛铁矿精矿中主要含有FeTiO3、Fe2O3、FeO,再用浓硫酸处理,得到强酸性溶液中含有TiOSO4、Fe2(SO4)3、FeSO4及未反应的硫酸等,加入试剂A后冷却、结晶、过滤得到硫酸亚铁晶体,则A为Fe,将Fe3+转化为Fe2+.滤液进行水解得到H2TiO3,用硫酸洗去杂化,再煅烧得到TiO2,TiO2、C、Cl2反应得到TiCl4及CO2.
(1)反应①为非氧化还原反应,结合化合价代数和为0,可知FeTiO3中钛元素的化合价为+4,由上述分析可知A为Fe,
故答案为:+4;Fe;
(2)氧化铝与氢氧化钠反应生成偏铝酸钠与水,二氧化硅与氢氧化钠反应生成硅酸钠与水,相应反应离子方程式为:Al2O3+2OH-═2AlO2-+H2O、SiO2+2OH-═SiO32-+H2O,
故答案为:Al2O3+2OH-═2AlO2-+H2O;SiO2+2OH-═SiO32-+H2O;
(3)温度过高水导致TiOSO4提前水解生成H2TiO3沉淀,Ti元素利用率减小,
故答案为:温度过高水导致TiOSO4提前水解生成H2TiO3沉淀;
(4)氯化过程是TiO2、C、Cl2反应得到TiCl4及CO2,反应方程式为:TiO2+C+2Cl2$\frac{\underline{\;900℃\;}}{\;}$TiCl4 +CO2,
C与氧气反应减小氧气浓度,使平衡正向移动,C与氧气反应为放热反应,温度升高,使平衡正向移动,促使反应顺利进行,
故答案为:TiO2+C+2Cl2$\frac{\underline{\;900℃\;}}{\;}$TiCl4 +CO2;C与氧气反应减小氧气浓度,使平衡正向移动,C与氧气反应为放热反应,温度升高,使平衡正向移动,促使反应顺利进行;
(5)TiCl4极易水解得到TiO2•xH2O,还生成HCl,反应方程式为:TiCl4+(x+2)H2O=TiO2•xH2O+4HCl,
故答案为:TiCl4+(x+2)H2O=TiO2•xH2O+4HCl.
点评 本题综合考查物质制备实验,关键是对工艺流程原理的理解,注意分析工艺流程中试剂线、原理线、操作线,要求学生具有一定分析和解决问题的能力,题目难度中等.

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案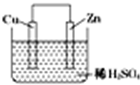 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是 ①①Cu为负极( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是 ①①Cu为负极( ) ②SO42-向正极移动
③电子是由Zn经外电路流向Cu
④Zn极上有H2产生
⑤若有1mol电子流经导线,则可产生的H2为0.5mol
⑥负极的电极反应式为Zn-2e-=Zn2+.
| A. | ①②③ | B. | ③④⑤ | C. | ③⑤⑥ | D. | ②③⑥ |
| A. | Si常用做信息高速公路的骨架--光导纤维的主要材料 | |
| B. | 测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热 | |
| C. | 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 | |
| D. | SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 |
| A. | 离子化合物中可能含共价键 | |
| B. | 共价化合物中可能含离子键 | |
| C. | 两种元素构成的共价化合物分子中的化学键都是极性键 | |
| D. | 含有非极性键的化合物一定是共价化合物 |
| A. | 核内的中子数为53 | |
| B. | 核内的电子数为135 | |
| C. | 核内的中子数与核外电子数之差为29 | |
| D. | 质量数为82 |
| A. | 卤化氢分子中,卤素的非金属性越强,共价键的极性也越强,稳定性也越强 | |
| B. | 以极性键结合的分子,不一定是极性分子 | |
| C. | 判断A2B或AB2型分子为极性分子必须知道该分子的空间构型 | |
| D. | 非极性分子中,各原子间都应以非极性键结合 |
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(mg) | 255 | 385 | 459 |
| 生成气体体积(mL) | 280 | 336 | 336 |
(2)参考合适的数据组合求得的Mg、Al的物质的量之比为1:1.
(3)在丙组实验之后,向容器中加入1mol•L-1的氢氧化钠溶液,能使合金中的铝恰好溶解,不形成含铝的沉淀,并使Mg2+刚好沉淀完全,再过滤出不溶固体,求滤液中各溶质的物质的量和所加入氢氧化钠溶液的体积.
 .
.