题目内容
为测定Na2CO3与Na2SO3混合物中各组分的含量,设计如下实验方案:
(1)方案一:称取一定质量的样品(10g),置于坩埚中加热至恒重,冷却,称取剩余固体质量为10.8g,计算:
①实验中加热至恒重的目的是 .
②样品中Na2CO3的质量分数为 ;
(2)方案二:如图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
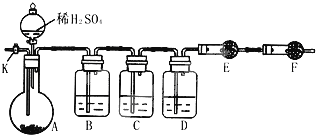
①已知仪器C中装有品红溶液,其作用是检验SO2是否除尽,有人提出该溶液可能引起Na2CO3含量的测量结果比实际值偏低,理由是 .
②实验室中备有以下常用试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液 d.氢氧化钠溶液 e.无水硫酸铜 f.碱石灰 g.五氧化二磷 h.无水氯化钙.请将下列容器中应盛放的试剂序号填入相应空格:B中 ,E中 .
③实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的氮气,这样做的目的是 .
(1)方案一:称取一定质量的样品(10g),置于坩埚中加热至恒重,冷却,称取剩余固体质量为10.8g,计算:
①实验中加热至恒重的目的是
②样品中Na2CO3的质量分数为
(2)方案二:如图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)

①已知仪器C中装有品红溶液,其作用是检验SO2是否除尽,有人提出该溶液可能引起Na2CO3含量的测量结果比实际值偏低,理由是
②实验室中备有以下常用试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液 d.氢氧化钠溶液 e.无水硫酸铜 f.碱石灰 g.五氧化二磷 h.无水氯化钙.请将下列容器中应盛放的试剂序号填入相应空格:B中
③实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的氮气,这样做的目的是
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)①加热恒重使亚硫酸钠完全被氧化;
②依据质量减少计算亚硫酸钠的质量来计算碳酸钠质量分数;
(2)①装置C中的品红是检验二氧化硫是否除尽;二氧化碳可能溶解于水;
②分析实验过程稀硫酸和碳酸钠和亚硫酸钠反应生成二氧化碳二氧化硫气体,为测定含量需要测定二氧化碳的质量来计算得到,所以实验过程:装置B先用高锰酸钾溶液吸收二氧化硫气体,通过装置C中 的品红试液检验二氧化硫是否除尽,利用装置D中浓硫酸除去水蒸气,通过装置E吸收生成的二氧化碳气体称量得到二氧化碳质量;
③通入氮气的作用是板整套装置中生成的二氧化碳气体全部赶到装置E中被吸收.
②依据质量减少计算亚硫酸钠的质量来计算碳酸钠质量分数;
(2)①装置C中的品红是检验二氧化硫是否除尽;二氧化碳可能溶解于水;
②分析实验过程稀硫酸和碳酸钠和亚硫酸钠反应生成二氧化碳二氧化硫气体,为测定含量需要测定二氧化碳的质量来计算得到,所以实验过程:装置B先用高锰酸钾溶液吸收二氧化硫气体,通过装置C中 的品红试液检验二氧化硫是否除尽,利用装置D中浓硫酸除去水蒸气,通过装置E吸收生成的二氧化碳气体称量得到二氧化碳质量;
③通入氮气的作用是板整套装置中生成的二氧化碳气体全部赶到装置E中被吸收.
解答:
解:(1)①加热恒重使亚硫酸钠完全被氧化,便于测定固体质量来计算各成分的质量分数,
故答案为:使亚硫酸钠氧化完全;
②依据质量减少计算亚硫酸钠的质量来计算碳酸钠质量分数,称取一定质量的样品(10g),置于坩埚中加热至恒重,冷却,称取剩余固体质量为10.8g,固体质量增加是氧气的质量,则
2Na2SO3+O2=2Na2SO4
2×126 32
m(Na2SO3) 10.8g-10g
m=6.3g
则碳酸钠质量分数=
×100%=37%,
故答案为:37%;
(2)①装置C中的品红是检验二氧化硫是否除尽;有人提出该溶液可能引起Na2CO3含量的测量结果比实际值偏低可能是二氧化碳溶解于水减少,
故答案为:二氧化碳可溶于水;
②分析实验过程稀硫酸和碳酸钠和亚硫酸钠反应生成二氧化碳二氧化硫气体,为测定含量需要测定二氧化碳的质量来计算得到,所以实验过程:装置B先用高锰酸钾溶液吸收二氧化硫气体,通过装置C中 的品红试液检验二氧化硫是否除尽,利用装置D中浓硫酸除去水蒸气,通过装置E吸收生成的二氧化碳气体称量得到二氧化碳质量,最后的干燥管是避免空气中二氧化碳和水蒸气干扰二氧化碳质量的测定,
故答案为:c;f;
③通入氮气的作是把整套装置中生成的二氧化碳气体全部赶到装置E中被吸收,
故答案为:使ABCD各装置中残留的二氧化碳进入E被充分吸收.
故答案为:使亚硫酸钠氧化完全;
②依据质量减少计算亚硫酸钠的质量来计算碳酸钠质量分数,称取一定质量的样品(10g),置于坩埚中加热至恒重,冷却,称取剩余固体质量为10.8g,固体质量增加是氧气的质量,则
2Na2SO3+O2=2Na2SO4
2×126 32
m(Na2SO3) 10.8g-10g
m=6.3g
则碳酸钠质量分数=
| 10g-6.3g |
| 10g |
故答案为:37%;
(2)①装置C中的品红是检验二氧化硫是否除尽;有人提出该溶液可能引起Na2CO3含量的测量结果比实际值偏低可能是二氧化碳溶解于水减少,
故答案为:二氧化碳可溶于水;
②分析实验过程稀硫酸和碳酸钠和亚硫酸钠反应生成二氧化碳二氧化硫气体,为测定含量需要测定二氧化碳的质量来计算得到,所以实验过程:装置B先用高锰酸钾溶液吸收二氧化硫气体,通过装置C中 的品红试液检验二氧化硫是否除尽,利用装置D中浓硫酸除去水蒸气,通过装置E吸收生成的二氧化碳气体称量得到二氧化碳质量,最后的干燥管是避免空气中二氧化碳和水蒸气干扰二氧化碳质量的测定,
故答案为:c;f;
③通入氮气的作是把整套装置中生成的二氧化碳气体全部赶到装置E中被吸收,
故答案为:使ABCD各装置中残留的二氧化碳进入E被充分吸收.
点评:本题考查了物质性质和组成的实验探究实验设计和性质验证,反应过程的计算分析应用,实验步骤设计和现象分析是解题关键,题目难度中等.

练习册系列答案
相关题目
某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度.有关的叙述正确的是( )
| A、H2Y的电离方程式为:H2Y=2H++Y2- |
| B、在该酸式盐溶液中:[Na+]>[Y2-]>[HY-]>[OH-]>[H+] |
| C、HY-的水解方程式:HY-+H2O?H3O++Y2- |
| D、在该酸式盐溶液中:[Na+]>[HY-]>[OH-]>[H+]>[Y2-] |
生活是化学的源泉,下列有关生活中的化学叙述不正确的是( )
| A、铁强化酱油可通过膳食补充人体所需的铁元素 |
| B、变质的植物油有难闻的特殊气味,是由于植物油发生了水解反应 |
| C、一定浓度的双氧水可用于伤口的消毒 |
| D、蔬菜中含有维生素C,生吃新鲜蔬菜要比熟吃时维生素C的损失大 |
1-丁烯醇(CH2=CH-CH2-CH2OH)可发生的化学反应类型有:( )
①加成 ②氧化 ③酯化 ④加聚 ⑤取代.
①加成 ②氧化 ③酯化 ④加聚 ⑤取代.
| A、①②③④⑤ |
| B、只有①②③ |
| C、只有①②③④ |
| D、只有①③④ |
 纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.
纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.
 .
.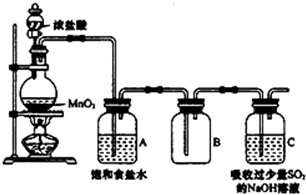 某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:
某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示: 在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表: