题目内容
16.理论分析,二氧化氮具有氧化性又具有还原性,某同学利用一些简单装置和所提供的试剂,设计了实验以从实验的角度对这一理论甲乙分析证明,简单装置如图所示:
试剂:a.浓硫酸 b.浓硝酸 c.浓盐酸 d.铜屑 e.二氧化锰 f.KMrO4酸性溶液 g.溴水
(1)为了证明二氧化化氮具有氧化性,应选用的装置有(填字母)①B,所选试剂是(填编号字母,下同)bd②A其中的试剂是ad,还有装置是③D
(2)说明二氧化氮的氧化性,明显的现象应该出现在装置D中,现象是D中红棕色气体褪色,在吸收尾气的试管口有无色气体变为红棕色,检验水溶液里氧化产物生成的阴离子的方法用离子方程式表示是Ba2++SO42-=BaSO4↓
(3)为了证明二氧化化氮具有还原性,应选用的装置有①B,其中的试剂是bd和②C,其中的试剂是f.反应时的现象是高锰酸钾溶液褪色,氧化产物是硝酸.
分析 (1)要证明二氧化氮具有氧化性,即用二氧化氮与还原剂反应,可用浓硝酸与铜反应制得二氧化氮,用铜与浓硫酸制得二氧化硫,使二氧化硫与二氧化氮两种气体在D装置中;
(2)若二氧化氮红棕色褪色,则可说明二氧化硫被二氧化氮氧化,在水溶液中生成硫酸根离子,可以利用氯化钡检验;
(3)为了证明二氧化氮具有还原性,即用二氧化氮与氧化剂反应,常见的氧化剂应为高锰酸钾,若二氧化氮能使高锰酸钾溶液褪色,则说明二氧化氮具有还原性.
解答 解:(1)要证明二氧化氮具有氧化性,即用二氧化氮与还原剂反应,可用浓硝酸与铜反应制得二氧化氮,用铜与浓硫酸制得二氧化硫,使二氧化硫与二氧化氮两种气体在D装置中反应即可证明,所以应选用的装置有A,所选试剂是ad,用来制二氧化硫,用装置B,试剂bd制二氧化氮,二氧化硫和二氧化氮在装置D中反应,
故答案为:B;bd;A;ad;D;
(2)若二氧化氮红棕色褪色,则可说明二氧化硫被二氧化氮氧化,所以明显的现象应该出现在装置D中,现象是红棕色褪色,在吸收尾气的试管口有无色气体变为红棕色,在水溶液中生成硫酸根离子,可以利用氯化钡检验,反应的离子方程式为Ba2++SO42-=BaSO4↓,
故答案为:D;D中红棕色气体褪色,在吸收尾气的试管口有无色气体变为红棕色;Ba2++SO42-=BaSO4↓;
(3)为了证明二氧化氮具有还原性,即用二氧化氮与氮化剂反应,常见的氧化剂应为高锰酸钾,所以可以用B装置制二氧化氮,用试剂bd制二氧化氮,用C装置放高锰酸钾溶液,选试剂f,若二氧化氮能使高锰酸钾溶液褪色,则说明二氧化氮具有还原性,此时二氧化氮被氧化成硝酸,
故答案为:B;bd;C;f;高锰酸钾溶液褪色;硝酸.
点评 本题利用Cu与浓HNO3的反应制取NO2,再检验二氧化氮的氧化性和还原性,明确物质的性质是解本题关键,注意灵活运用氧化还原反应的原理分析问题,难度中等.

| A. | 7.8g苯中含有碳碳双键数目为0.3NA | |
| B. | 1mol的羟基(-OH)所含电子的数目为9NA | |
| C. | 25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| D. | 1.0L 1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA |
| A. | 电解质:CO2、Ca(OH)2、H2O、HNO3 | B. | 碱:NaOH、Ba(OH)2、Na2CO3、NH3•H2O | ||
| C. | 碱性氧化物:CaO、Na2O、FeO、Mn2O7 | D. | 盐:NH4NO3、KAl(SO4)2、NH4Cl、NaHCO3 |
| A. | 移去部分O2 | B. | 增大容器体积 | C. | 移去部分SO3 | D. | 升高体系温度 |
| A. | 炒菜锅里失火时,可立即用水灭火 | |
| B. | 天津某仓库8月12日发生大爆炸,其原因主要是大量钠、电石等引发,消防员们可用水灭火 | |
| C. | 浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液 | |
| D. | 浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤 |
| A. | HF、HCl、HBr、HI | B. | KMnO4、CuCl2、FeCl3,NaCl | ||
| C. | KNO3、KI、AgNO3、Na2CO3 | D. | 溴水、NaCl、NaBr、KI |

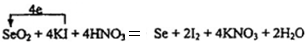 .
.