题目内容
元素周期表是学习化学的重要工具,它包含了许多的信息和规律.下表是元素周期表短周期的一部分,请从下表①~⑩十种元素中选择适当的元素回答下列问题:
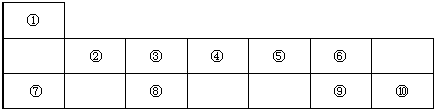
用”化学用语”填空:
(1)元素③的某原子中有6个中子写出该原子的核素符号: .
(2)比较⑨⑩的最高价氧化物的水化物的酸性强弱 .
(3)上述两非金属元素间能形成AB2型化合物,分子中共有38个电子写出它的电子式 .
(4)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑧的氢氧化物有相似的性质,与元素⑧的性质相似的下一周期不同主族的元素是 (填元素符号).写出元素②的氢氧化物与元素⑦的最高价氧化物的水化物溶液反应的离子方程式 .
(5)⑤元素和①元素可以形成多种化合物,其中有一种离子化合物A中两元素的原子个数比为1:5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构.写出A与水反应的化学方程式 .
(6)X、Y、Z、甲、乙、丙是由④⑤⑥分别与①形成的化合物,六种化合物可以排成下表,其中同一横行的分子中电子数相同,同一纵行的物质所含元素种类相同,其中X、Y、甲常温常压下为气体,Z、乙、丙常温常压下为液体.
①X、Y、甲的沸点高低是 .
②乙和丙常作火箭推进器的燃料,反应后的产物无污染.已知8g液态乙与足量液态丙完全反应,产物均为气体时,放出热量为160.35kJ,试写出该反应的热化学方程式: .

用”化学用语”填空:
(1)元素③的某原子中有6个中子写出该原子的核素符号:
(2)比较⑨⑩的最高价氧化物的水化物的酸性强弱
(3)上述两非金属元素间能形成AB2型化合物,分子中共有38个电子写出它的电子式
(4)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑧的氢氧化物有相似的性质,与元素⑧的性质相似的下一周期不同主族的元素是
(5)⑤元素和①元素可以形成多种化合物,其中有一种离子化合物A中两元素的原子个数比为1:5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构.写出A与水反应的化学方程式
(6)X、Y、Z、甲、乙、丙是由④⑤⑥分别与①形成的化合物,六种化合物可以排成下表,其中同一横行的分子中电子数相同,同一纵行的物质所含元素种类相同,其中X、Y、甲常温常压下为气体,Z、乙、丙常温常压下为液体.
| X | Y | Z |
| 甲 | 乙 | 丙 |
②乙和丙常作火箭推进器的燃料,反应后的产物无污染.已知8g液态乙与足量液态丙完全反应,产物均为气体时,放出热量为160.35kJ,试写出该反应的热化学方程式:
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知①为H、②为Be、③为B、④为C、⑤为N、⑥为O、⑦为Na、⑧为Al、⑨为S、⑩为Cl.
(1)原子符号AZX中左下角Z代表质子数,左上角A代表质量数,X为元素符号,其中质量数=质子数+中子数;
(2)非金属性越强,最高价含氧酸的酸性越强;
(3)上述两非金属元素间能形成AB2型化合物,分子中共有38个电子,则该分子为CS2,分子中C原子与S原子之间形成2对共用电子对;
(4)根据对角线规则及位于金属与非金属交界处进行判断;氢氧化铍与氢氧化铝的性质相似,则 Be(OH)2与氢氧化钠反应生成NaBeO2与水;
(5)⑤元素和①元素可以形成多种化合物,其中有一种离子化合物A中两元素的原子个数比为1:5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构,则该离子化合物为NH4H,与水发生水解反应生成一水合氨与氢气;
(6)X、Y、Z、甲、乙、丙是由④⑤⑥分别与①形成的化合物,其中同一横行的分子中电子数相同,考虑10电子、18电子微粒,同一纵行的物质所含元素种类相同,其中X、Y、甲常温常压下为气体,Z、乙、丙常温常压下为液体,可推知X为CH4、甲为C2H6,Y为NH3、乙为N2H4,Z为H2O、丙为H2O2.
(1)原子符号AZX中左下角Z代表质子数,左上角A代表质量数,X为元素符号,其中质量数=质子数+中子数;
(2)非金属性越强,最高价含氧酸的酸性越强;
(3)上述两非金属元素间能形成AB2型化合物,分子中共有38个电子,则该分子为CS2,分子中C原子与S原子之间形成2对共用电子对;
(4)根据对角线规则及位于金属与非金属交界处进行判断;氢氧化铍与氢氧化铝的性质相似,则 Be(OH)2与氢氧化钠反应生成NaBeO2与水;
(5)⑤元素和①元素可以形成多种化合物,其中有一种离子化合物A中两元素的原子个数比为1:5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构,则该离子化合物为NH4H,与水发生水解反应生成一水合氨与氢气;
(6)X、Y、Z、甲、乙、丙是由④⑤⑥分别与①形成的化合物,其中同一横行的分子中电子数相同,考虑10电子、18电子微粒,同一纵行的物质所含元素种类相同,其中X、Y、甲常温常压下为气体,Z、乙、丙常温常压下为液体,可推知X为CH4、甲为C2H6,Y为NH3、乙为N2H4,Z为H2O、丙为H2O2.
解答:
解:由元素在周期表中位置,可知①为H、②为Be、③为B、④为C、⑤为N、⑥为O、⑦为Na、⑧为Al、⑨为S、⑩为Cl.
(1)元素③为B,某原子中有6个中子,该原子的核素符号为:511B,故答案为:511B;
(2)非金属性Cl>S,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>H2SO4 ,故答案为:HClO4>H2SO4 ;
(3)上述两非金属元素间能形成AB2型化合物,分子中共有38个电子,则该分子为CS2,分子中C原子与S原子之间形成2对共用电子对,电子式为: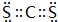 ,故答案为:
,故答案为: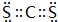 ;
;
(4)与元素⑧的性质相似的下一周期不同主族的元素是Ge,氢氧化铍与氢氧化铝的性质相似,则 Be(OH)2与氢氧化钠反应生成NaBeO2与水,反应离子方程式为:Be(OH)2+2OH-═BeO22-+2H2O,故答案为:Ge;Be(OH)2+2OH-═BeO22-+2H2O;
(5)⑤元素和①元素可以形成多种化合物,其中有一种离子化合物A中两元素的原子个数比为1:5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构,则该离子化合物为NH4H,与水发生水解反应生成一水合氨与氢气,反应方程式为:NH5+H2O=NH3?H2O+H2↑,故答案为:NH5+H2O=NH3?H2O+H2↑;
(6)X、Y、Z、甲、乙、丙是由④⑤⑥分别与①形成的化合物,其中同一横行的分子中电子数相同,考虑10电子、18电子微粒,同一纵行的物质所含元素种类相同,其中X、Y、甲常温常压下为气体,Z、乙、丙常温常压下为液体,可推知X为CH4、甲为C2H6,Y为NH3、乙为N2H4,Z为H2O、丙为H2O2.
①氨气分子之间存在氢键,沸点最高,乙烷相对分子质量高于甲烷,乙烷沸点高于甲烷,故沸点NH3>C2H6>CH4,故答案为:NH3>C2H6>CH4;
②8g液态乙与足量液态丙完全反应,产物均为气体时,放出热量为160.35kJ,则1mol乙反应放出的热量为160.35kJ×
=641.40kJ,则热化学方程式为N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=-641.40kJ/mol,故答案为:N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=-641.40kJ/mol.
(1)元素③为B,某原子中有6个中子,该原子的核素符号为:511B,故答案为:511B;
(2)非金属性Cl>S,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>H2SO4 ,故答案为:HClO4>H2SO4 ;
(3)上述两非金属元素间能形成AB2型化合物,分子中共有38个电子,则该分子为CS2,分子中C原子与S原子之间形成2对共用电子对,电子式为:
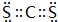 ,故答案为:
,故答案为: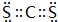 ;
;(4)与元素⑧的性质相似的下一周期不同主族的元素是Ge,氢氧化铍与氢氧化铝的性质相似,则 Be(OH)2与氢氧化钠反应生成NaBeO2与水,反应离子方程式为:Be(OH)2+2OH-═BeO22-+2H2O,故答案为:Ge;Be(OH)2+2OH-═BeO22-+2H2O;
(5)⑤元素和①元素可以形成多种化合物,其中有一种离子化合物A中两元素的原子个数比为1:5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构,则该离子化合物为NH4H,与水发生水解反应生成一水合氨与氢气,反应方程式为:NH5+H2O=NH3?H2O+H2↑,故答案为:NH5+H2O=NH3?H2O+H2↑;
(6)X、Y、Z、甲、乙、丙是由④⑤⑥分别与①形成的化合物,其中同一横行的分子中电子数相同,考虑10电子、18电子微粒,同一纵行的物质所含元素种类相同,其中X、Y、甲常温常压下为气体,Z、乙、丙常温常压下为液体,可推知X为CH4、甲为C2H6,Y为NH3、乙为N2H4,Z为H2O、丙为H2O2.
①氨气分子之间存在氢键,沸点最高,乙烷相对分子质量高于甲烷,乙烷沸点高于甲烷,故沸点NH3>C2H6>CH4,故答案为:NH3>C2H6>CH4;
②8g液态乙与足量液态丙完全反应,产物均为气体时,放出热量为160.35kJ,则1mol乙反应放出的热量为160.35kJ×
| 1mol×32g/mol |
| 8g |
点评:本题考查元素周期表与元素周期律、元素化合物推断等,侧重考查学生对知识的迁移应用,(6)为难点,熟悉10电子和18电子微粒,题目难度中等.

练习册系列答案
相关题目
下列数量的各物质所含原子数(包括离子)由小到大顺序排列的是( )
①0.5molNH3 ②22.4L氦气(标况下) ③9mL液态水 ④0.2molNa3PO4.
①0.5molNH3 ②22.4L氦气(标况下) ③9mL液态水 ④0.2molNa3PO4.
| A、②③④① | B、④②③① |
| C、①④③② | D、①④②③ |
 ),其反应是
),其反应是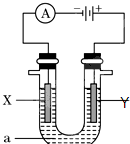 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: