题目内容
实验室常用盐酸的质量分数为36.5%,密度为1.20g/cm3.
(1)此浓盐酸的物质的量浓度是多少?(列式计算)
(2)配制100mL3.00mol/L的盐酸,需以上浓盐酸多少mL?(列式计算)
(3)100mL3.00mol/L该盐酸与300mL2.00mol/L盐酸混合后若体积为400ml,则此混合溶液的物质的量浓度是多少?(列式计算)
(1)此浓盐酸的物质的量浓度是多少?(列式计算)
(2)配制100mL3.00mol/L的盐酸,需以上浓盐酸多少mL?(列式计算)
(3)100mL3.00mol/L该盐酸与300mL2.00mol/L盐酸混合后若体积为400ml,则此混合溶液的物质的量浓度是多少?(列式计算)
考点:物质的量浓度的相关计算
专题:计算题
分析:(1)根据c=
计算浓盐酸的物质的量浓度;
(2)根据稀释定律计算需要浓盐酸的体积;
(3)根据n=cV计算各盐酸中HCl的物质的量,再根据c=
计算混合后盐酸的物质的量浓度.
| 1000ρω |
| M |
(2)根据稀释定律计算需要浓盐酸的体积;
(3)根据n=cV计算各盐酸中HCl的物质的量,再根据c=
| n |
| V |
解答:
解:(1)质量分数为36.5%,密度为1.20g/cm3浓盐酸的物质的量浓度=(1000×1.20×36.5%÷36.5)mol/L=12.0mol/L,
答:该浓盐酸的物质的量浓度为12.0mol/L;
(2)设需浓盐酸V L,根据稀释定律,则:
3.00mol/L×0.1L=12.0mol/L?V
解得V=0.025 L=25.0mL,
答:需要浓盐酸体积为25.0mL;
(3)100mL3.00mol/L该盐酸与300mL2.00mol/L盐酸混合后若体积为400ml,则此混合溶液的物质的量浓度=(0.1L×3mol/L+0.3L×2mol/L)÷0.4L=2.25mol/L,
答:此混合溶液的物质的量浓度是2.25 mol/L.
答:该浓盐酸的物质的量浓度为12.0mol/L;
(2)设需浓盐酸V L,根据稀释定律,则:
3.00mol/L×0.1L=12.0mol/L?V
解得V=0.025 L=25.0mL,
答:需要浓盐酸体积为25.0mL;
(3)100mL3.00mol/L该盐酸与300mL2.00mol/L盐酸混合后若体积为400ml,则此混合溶液的物质的量浓度=(0.1L×3mol/L+0.3L×2mol/L)÷0.4L=2.25mol/L,
答:此混合溶液的物质的量浓度是2.25 mol/L.
点评:本题考查浓度有关计算,难度不大,注意理解掌握物质的量浓度与质量分数之间的关系.

练习册系列答案
相关题目
下列物质属于混合物的是( )
| A、冰水混合物 |
| B、盐酸 |
| C、纯醋酸 |
| D、CuSO4?5H2O |
 2010上海世博上,零排放、太阳能、绿色光源等成为高科技亮点.
2010上海世博上,零排放、太阳能、绿色光源等成为高科技亮点.
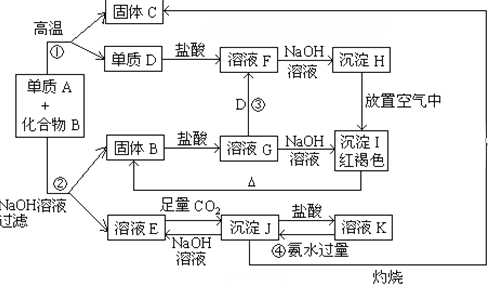
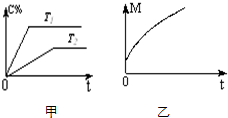 在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g)?p C(g)+q D(g).
在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g)?p C(g)+q D(g).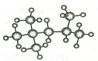 按系统命名法命名为:
按系统命名法命名为: