题目内容
1.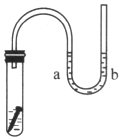 如图所示,试管中放一枚铁钉,并盛放一定量的NaCl溶液,导管中有少量蒸馏水.
如图所示,试管中放一枚铁钉,并盛放一定量的NaCl溶液,导管中有少量蒸馏水.(1)数天后观察到的现象有a端液面上升b端液面下降、铁钉表面有红棕色铁锈生成,说明铁钉发生了吸氧腐蚀.
(2)其中作正极的是C,电极反应式为O2+2H2O+4e-=4OH-.
(3)试管中气体的平均相对分子量将减小(填“增大”、“减小”、或“不变”).
分析 铁钉中含有铁和碳,铁、碳和电解质溶液构成了原电池,较活泼的金属铁作负极,碳作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,试管中盛放一定量的NaCl溶液是中性溶液,发生吸氧腐蚀,据此分析解答.
解答 解:(1)根据以上分析,铁钉中含有铁和碳,发生吸氧腐蚀,负极上铁失电子发生氧化反应,观察到的现象为铁钉表面有红棕色铁锈生成,正极上氧气得电子发生还原反应,观察到的现象为a端液面上升,b端液面下降,故答案为:a端液面上升,b端液面下降;铁钉表面有红棕色铁锈生成; 吸氧;
(2)根据以上分析,正极的是C,氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-;故答案为:C;O2+2H2O+4e-=4OH-;
(3)因为发生吸氧腐蚀,氧气被消耗,则试管中气体的平均相对分子量将减小,故答案为:减小.
点评 本题考查了金属的腐蚀与防护,难度不大,明确生铁在中性溶液中易发生吸氧腐蚀,在酸性溶液中易发生析氢腐蚀.

练习册系列答案
相关题目
6.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 2 mol•L-1 的Na2SO4溶液中含有4 NA个Na+ | |
| B. | 将含有0.1 mol FeCl3的饱和溶液逐滴滴入足量沸水中,得到Fe(OH)3胶体数目为0.1 NA | |
| C. | 在标准状况下,11.2 L氖气中含有NA个氖原子1100℃ | |
| D. | 7.8 g Na2O2中阴离子数目为0.1NA |
7.下列有关化学用语表示正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | 醛基的电子式: | ||
| C. | 乙酸的最简式:CH2O | D. | 乙醇分子比例模型: |
6.下列离子方程式书写正确的是( )
| A. | 向小苏打溶液中加入少量石灰水:HCO3-+OH-+Ca2+=CaCO3↓+2H2O | |
| B. | 向烧碱溶液中加入铝片:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| C. | 向HI溶液中加入Fe(OH)3固体:Fe(OH)3+3H+=Fe3++3H2O | |
| D. | 向MgSO4溶液中加入Ba(OH)2溶液:Ba2++SO42--=BaSO4↓ |
13. 反应Ⅰ和反应Ⅱ都是有机合成中的重要反应:下列有关说法正确的是( )
反应Ⅰ和反应Ⅱ都是有机合成中的重要反应:下列有关说法正确的是( )
 反应Ⅰ和反应Ⅱ都是有机合成中的重要反应:下列有关说法正确的是( )
反应Ⅰ和反应Ⅱ都是有机合成中的重要反应:下列有关说法正确的是( )| A. | 苯乙酮的一氯代物有6种同分异构体 | |
| B. | 苯乙酮经反应Ⅰ所得产物的所有原子不可能在同一平面内 | |
| C. | 反应Ⅱ为取代反应 | |
| D. | 反应Ⅱ可以在强碱性条件下进行 |
11.在标准状况下,由CO和CO2组成的混合气体13.44L,质量为20g,此混合气体中C和O两种原子的物质的量之比为( )
| A. | 3:4 | B. | 4:3 | C. | 2:1 | D. | 1:2 |
 能源的开发利用与人类社会的可持续发展息息相关.
能源的开发利用与人类社会的可持续发展息息相关.