题目内容
8.食品容易被空气氧化而变质,故在装有月饼的袋子里常放有干燥剂及铁粉,这是利用了铁粉的( )| A. | 酸性 | B. | 碱性 | C. | 氧化性 | D. | 还原性 |
分析 为防止食品变质,应降低氧气的浓度,结合铁粉具有还原性解答该题.
解答 解:放在食品包装袋内的小袋中,以防止食品因被氧化而变质说明该物质应具有还原性能够与氧气反应,则铁粉表现还原性,
故选D.
点评 本题考查了常见的食品添加剂以及铁的性质,为高频考点,侧重于化学与生活的考查,有利于培养学生良好的科学素养,熟悉相关物质的性质是解题关键,题目难度不大,注意对相关知识的积累.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
18.Al溶于NaOH溶液中,Al失去1mol e-时,消耗的氧化剂为( )
| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |
19.常温下,将0.1L0.1mol/L Na2S2O3溶液与一定量的pH=2的硫酸溶液混合,放出VL气体.NA代表阿伏加德罗常数的值,下列说法正确的足( )
| A. | pH=2的硫酸溶液含有H+数目为0.0lNA | |
| B. | 该反应释放SO2分子数目为$\frac{V}{22.4}$NA | |
| C. | 反应中每摩尔Na2S2O3转移的电子数目为4NA | |
| D. | 若98gH2SO4溶于水完全电离,其断裂的共价键数目为2NA |
16.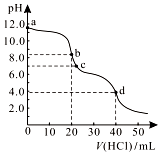 常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示.下列有关叙述正确的是( )
常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示.下列有关叙述正确的是( )
 常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示.下列有关叙述正确的是( )
常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示.下列有关叙述正确的是( )| A. | a点溶液呈碱性的原因用离子方程式表示为:CO32-+2H2O?H2CO3+2OH- | |
| B. | c点处的溶液中c(Na+)-c(Cl-)=c(HCO3-)+2c(CO32-) | |
| C. | 滴定过程中使用甲基橙作为指示剂比酚酞更准确 | |
| D. | d点处溶液中水电离出的c(H+)大于b点处 |
3.短周期主族元素M、R、X、Y、Z的核电荷数依次增大.其中M的族序数和原子序数相等,R的单质在空气中的体积分数最大,X、Y、Z同周期,且Xn+离子在同周期元素离子中半径最小,Y的氧化物是形成酸雨的主要物质.下列说法正确的是( )
| A. | 气态氢化物的热稳定性:Y>Z | |
| B. | Y元素的氧化物对应的水化物一定是强酸 | |
| C. | M与R可形成含非极性键的化合物 | |
| D. | 固体X2Y3可在水溶液中制取 |
13.现有氯化钠、氯化铝、氯化铁、氯化镁四种溶液,只用一种试剂通过一步实验就能加从区别,这种试剂是
( )
( )
| A. | KSCN溶液 | B. | BaCl2溶液 | C. | NaOH溶液 | D. | HCl溶液 |
20.下列实验能达到对应实验目的是( )


| A. | 用装置甲完成实验室制取氯气 | |
| B. | 用装置乙除去二氧化碳中的少量氯化氢 | |
| C. | 用装置丙分离二氧化锰和氯化锰溶液 | |
| D. | 用装置丁蒸干碳酸氢钠溶液制NaHCO3固体 |
11.“蛟龙”号载人潜水器7000米级海试圆满成功,标志着我国深海载人技术达到国际领先水平,据国际海床管理局估计,多金属硫化矿(含Cu、Zn、Pb、Mn、Fe、Ag、Au等多种有色金属和贵金属元素的硫化物)中每种金属的储量最多可达1.1亿吨,焙烧CuFeS2的主要反应之一;4CuFeS2+13O2$\frac{\underline{\;高温\;}}{\;}$4CuO+2Fe2O3+8SO2,关于该反应的叙述正确的是( )
| A. | CuFeS2中硫的化合价为-1价 | |
| B. | Fe2O3为氧化产物,SO2是还原产物 | |
| C. | lmolCuFeS2反应转移电子为13mol | |
| D. | 该反应的所有产物均既是氧化产物,又是还原产物 |