题目内容
15.如果人体内的CO2不能顺利排除体外会造成酸中毒,缓冲溶液可以抵御外来少量酸或碱对溶液pH的影响,人体血液里主要通过碳酸氢盐缓冲体系(H2CO3/HCO3-)维持pH稳定.己知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6,c(HCO3-):c(H2CO3)≈20:1,lg2=0.3.(1)由题给数据可算得正常人体血液的pH7.4(保留一位小数).
(2)正常人体血液中H2CO3、HCO3-、OH-、H+四种微粒浓度由大到小关系为C(HCO3-)>C(H2CO3)>C(OH-)>C(H+)
(3)当少量的酸、碱进入血液中时,血液pH变化不大,其原因是当少量酸进入血液中时,HCO3-就与H+发生反应来维持血液的pH稳定,当少量碱进入血液中时,H2CO3就与OH-发生反应来维持血液的pH稳定.
分析 (1)Ka=$\frac{c(HC{{O}_{3}}^{-})c({H}^{+})}{c({H}_{2}C{O}_{3})}$,Ka=10-6.1mol•L-1,正常血液中c(HCO3-):c(H2CO3)≈20:1;
(2)正常血液中c(HCO3-):c(H2CO3)≈20:1,碳酸氢根离子浓度大于碳酸浓度,溶液呈碱性;
(3)根据血液中存在的电离平衡分析,HCO3-、CO32-均水解显碱性.
解答 解:(1)Ka=$\frac{c(HC{{O}_{3}}^{-})c({H}^{+})}{c({H}_{2}C{O}_{3})}$,Ka=10-6.1mol•L-1,正常血液中c(HCO3-):c(H2CO3)≈20:1,则c(H+)=10-7.4mol•L-1,则pH=7.4,
故答案为:7.4;
(2)正常血液中c(HCO3-):c(H2CO3)≈20:1,碳酸氢根离子浓度大于碳酸浓度,溶液呈碱性,溶液中离子浓度大小为:c(HCO3-)>c(H2CO3)>c(OH-)>c(H+);
故答案为:c(HCO3-)>c(H2CO3)>c(OH-)>c(H+);
(3)血液是缓冲溶液,缓冲溶液可以抵御外来少量酸或碱对溶液pH的影响,当少量酸进入血液中时,HCO3-就与H+发生反应来维持血液的pH稳定,当少量碱进入血液中时,H2CO3就与OH-发生反应来维持血液的pH稳定;
故答案为:当少量酸进入血液中时,HCO3-就与H+发生反应来维持血液的pH稳定,当少量碱进入血液中时,H2CO3就与OH-发生反应来维持血液的pH稳定.
点评 本题考查了缓冲溶液、pH的计算及盐类水解、平衡影响因素、离子浓度大小比较,题目难度中等,明确习题中的信息及有关Ka的计算是解答本题的关键,侧重于考查学生的分析能力和计算能力.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案| A. | 泥水 | B. | 蒸馏水 | C. | 硫酸铜溶液 | D. | 氢氧化铁胶体 |
| A. | NH4Cl | B. | NaCl | C. | H2O | D. | Cl2 |
| A. | 在0.1mol/lHNO3溶液中加入FeCO3粉末,发生反应的离子方程式为:2FeCO3+2H+═2Fe2++CO2↑+H2O | |
| B. | 在$\frac{c(O{H}^{-})}{c({H}^{+})}$=1010的溶液中NO3-、I-、Na+、SO42-不能大量共存 | |
| C. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1 NA | |
| D. | 闭容器中2molNO与1molO2充分反应,产物的分子数小于2NA |
| 编号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸测得:0.1mol•L-1Na2SO3溶液的pH约为10;0.1mol•L-1NaHSO3溶液的pH约为5 | HSO3-结合H+的能力比SO32-强 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 配置FeCl2溶液时,先将FeCl2固体溶于适量盐酸中,再用蒸馏水稀释到所需浓度,最后向试剂瓶中加入少量铜粉 | 抑制Fe2+2水解,并防止Fe2+被氧化 |
| D | 向10mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,在滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| A. | A | B. | B | C. | C | D. | D |
| A. |  检查气密性 检查气密性 | B. |  制备氨气 | C. |  吸收氨尾气 | D. |  配制银氨溶液 |
| A. | 温度相同、体积相同的O2和N2 | B. | 质量相等、密度不等的N2和C2H2 | ||
| C. | 体积相同、密度不相等的CO和C2H4 | D. | 压强相同、体积相同的O2和H2 |
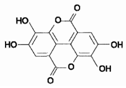 紫薯中的鞣花酸(结构如图)具有防癌和抗癌作用.
紫薯中的鞣花酸(结构如图)具有防癌和抗癌作用.
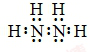 ;N2H4在水中的第一步电离方程式为N2H4+H2O?N2H5++OH-
;N2H4在水中的第一步电离方程式为N2H4+H2O?N2H5++OH-