题目内容
14.下列各组物质混合后,不能生成NaOH的是( )| A. | Na和H2O | B. | Na2O和H2O | ||
| C. | Ca(OH)2和Na2CO3溶液 | D. | Ca(OH)2和NaCl溶液 |
分析 据各物质的性质及物质之间的反应来分析生成物中是否有NaOH来解答.
解答 解:A、Na和H2O反应生成了氢氧化钠和氢气,故A正确;
B、Na2O和H2O反应生成了氢氧化钠,故B正确;
C、石灰水和Na2CO3溶液发生复分解反应生成了氢氧化钠和碳酸钙,故C正确;
D、石灰水和NaCl溶液不能发生复分解反应,故D错误;
故选:D.
点评 本题考查钠元素及其化合物知识及复分解反应的条件,难度不大.

练习册系列答案
相关题目
4.下列有机化学反应中属于取代反应的是( )
| A. | CH2═CH2+Cl2→CH2ClCH2Cl | B. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | ||
| C. | 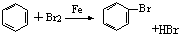 | D. | 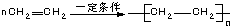 |
5.某溶液加入金属铝能放出氢气.下列各组离子在该溶液中一定可以大量共存的是( )
| A. | Al3+、NH4+、Cl-、SO42- | B. | Na+、Cl-、SO42-、HCO3- | ||
| C. | Na+、CH3COO-、NO3-、K+ | D. | K+、Na+、Cl-、SO42- |
2.下列叙述错误的是( )
| A. | 若向2mL 1mol/LNaOH溶液中先加入2滴1mol/L MgCl2溶液,再加入2滴1mol/L的FeCl3溶液,可以证明Mg(OH)2沉淀转化为Fe(OH)3沉淀 | |
| B. | 常温下,某溶液中由水电离出来的c(OH-)=1.0×10-12mol•L-1,则该溶液可能为盐酸,也可能为NaOH溶液 | |
| C. | 处理锅炉水垢中的CaSO4时,依次加入饱和NaCO3溶液和盐酸,水垢溶解,说明溶解度:S(CaCO3)<S(CaSO4) | |
| D. | 常温下的醋酸铵溶液呈中性,则溶液中c(H+)=c(OH-)=1.0×10-7mol•L-1 |
9.下列电离方程式正确的是( )
| A. | NaHS 溶于水:NaHS═Na++HS- HS-?H++S2- | |
| B. | (NH4)2SO4溶于水:(NH4)2SO4?2NH4++SO42- | |
| C. | 磷酸溶于水中:H3PO4═3H++PO43- | |
| D. | Al(OH)3的电离:Al(OH)3=Al3++3OH- |
1.以下对核外电子运动状况的描述正确的是( )
| A. | 电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转 | |
| B. | 能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动 | |
| C. | 能层序数越大,s原子轨道的半径越大 | |
| D. | 在同一能级上运动的电子,其运动状态可能相同 |
18.下列化学方程式中,不能用离子方程式 Ba2++SO42-=BaSO4↓表示的是( )
| A. | BaCl2+Na2SO4=BaSO4↓+2NaCl | B. | H2SO4+BaCl2═BaSO4↓+2HCl | ||
| C. | Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 | D. | BaCO3+H2SO4=BaSO4↓+CO2↑+H2O |