题目内容
11.喷泉是一种常见的现象,其产生的原因是存在压强差.
(1)实验开始之前,应先检验图Ⅰ装置的气密性是否良好,请用简单的语言来描述此过程:将导管下端插入水中,用热毛巾捂住烧瓶,如果有气泡冒出,且移走热毛巾后在导管内形成一段稳定的水柱,则证明气密性良好.
(2)用图Ⅰ装置进行喷泉实验,请写出引发喷泉的操作将胶头滴管的水挤入烧瓶.若图Ⅰ的圆底烧瓶中充满标况下的HCl气体,反应后溶液充满整个烧瓶,则烧瓶内溶液的物质的量浓度为0.045mol•L-1.
(3)在图Ⅱ的锥形瓶中,分别加入足量的下列物质后,能产生喷泉的是AC.
A.Cu与稀硝酸 B.Cu与稀硫酸
C.CaCO3与浓硝酸 D.Fe与浓硝酸
(4)某学生积极思考喷泉原理的应用,设计了如图Ⅲ所示的装置.
①如果关闭活塞c,打开活塞a、b,再挤压胶头滴管.则可能出现的现象为盛有氨气的集气瓶产生大量白烟.
②在①操作的基础上,打开活塞c,产生的现象是两烧瓶同时产生喷泉.
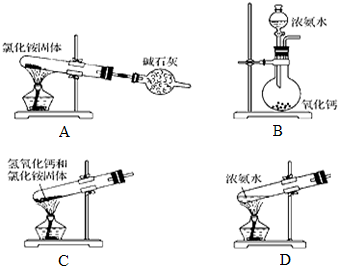
(5)实验室中某同学想制备部分氨气,设计了下面的装置,并选用相关试剂,其中错误的是AC.
分析 (1)根据实验室中常用的检验装置气密性的操作方法解答;
(2)氨气极易溶于水,通过挤压胶头滴管,使胶头滴管中的液体进入烧瓶,可引发喷泉;氨气极易溶于水,能够所以最后氨水溶于充满整个烧瓶,依据C=$\frac{n}{V}$计算溶液的物质的量浓度;
(3)图Ⅱ的锥形瓶中若能够生成的气体,使锥形瓶内气压增大,可形成喷泉,据此进行判断;
(4)①如果关闭活塞c,打开活塞a、b,再挤压胶头滴管,有氨气的瓶内气压减小,HCl与氨气结合生成氯化铵;
②在①操作的基础上,打开活塞c,瓶内气体减少,外压大于内压,形成喷泉;
(5)A.氯化铵受热分解生成氨气和氯化氢,冷却又生成氯化铵,不能制取氨气;
B.浓氨水易挥发,氧化钙与水反应放热;
C.试管应向下倾斜;
D.浓氨水加热易挥发.
解答 (1)检查该装置气密性是否良好的方法为:将导管下端插入水中,用热毛巾捂住烧瓶,如果有气泡冒出,且移走热毛巾后在导管内形成一段稳定的水柱,则证明气密性良好,
故答案为:将导管下端插入水中,用热毛巾捂住烧瓶,如果有气泡冒出,且移走热毛巾后在导管内形成一段稳定的水柱,则证明气密性良好;
(2)用图中Ⅰ装置进行喷泉实验,引发喷泉的操作方法为:将胶头滴管的水挤入烧瓶,这样烧瓶中压强减小,烧杯中液体被压入烧瓶中形成喷泉;
氯化氢极易溶于水,最终烧瓶中会充满溶液,设标况下氯化氢的体积为VL,则氯化氢的物质的量为:$\frac{V}{22.4L/mol}$,该溶液中HCl的物质的量的浓度为:$\frac{n}{V}$=$\frac{\frac{V}{22.4}}{V}$=$\frac{1}{22.4}$(mol/L)≈0.045mol•L-1;
故答案为:将胶头滴管的水挤入烧瓶;$\frac{1}{22.4}$mol•L-1或0.045mol•L-1;
(3)A.铜与稀硝酸反应生成NO气体,使锥形瓶压强增大,能产生喷泉,故A选;
B.Cu与稀硫酸不反应,锥形瓶内压强不变,不会产生喷泉,故B不选;
C.CaCO3与浓硝酸反应生成二氧化碳,能够使锥形瓶内压强增大,能够产生喷泉,故C选;
D.Fe与浓硝酸发生钝化,锥形瓶内压强不会增大,不会产生喷泉实验,故D不选;
故选:AC;
(4)①如果关闭活塞c,打开活塞a、b,再挤压胶头滴管,有氨气的瓶内气压减小,HCl与氨气结合生成氯化铵,则观察到HCl气体进入到盛有NH3的集气瓶,产生大量的白烟,故答案为:盛有氨气的集气瓶产生大量白烟;
②在①操作的基础上,打开活塞c,瓶内气体减少,外压大于内压,形成喷泉,则现象为①②两烧瓶同时产生喷泉,
故答案为:两烧瓶同时产生喷泉;
(5)A.氯化铵受热分解生成氨气和氯化氢,冷却又生成氯化铵,不能制取氨气,故A错误;
B.浓氨水易挥发,氧化钙与水反应放热,能够促进氨气的逸出,可以用来制备氨气,故B正确;
C.氢氧化钙与氯化铵反应生成水,试管应向下倾斜,故C错误;
D.加热浓氨水可以制取氨气,故D正确;
故选AC.
点评 本题通过喷泉实验为载体考查了喷泉实验原理及设计、氨气的制备和性质的检验,熟悉反应原理是解题关键,题目难度不大.

| A. | ①②③④⑤⑥ | B. | ②③④⑥ | C. | ②③⑤⑥ | D. | ①③④⑥ |
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
某同学设计用物质的量之比为1:1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如图所示:

(1)在①和②的实验过程中,需要控制的关键的实验条件是控制温度,在上述晶体中,C(填“A”或“C”)应为硝酸钾晶体.
(2)在①的实验过程中,需要进行的操作依次是加水溶解、蒸发浓缩、趁热过滤.
(3)粗产品中可能含有杂质离子Na+、Cl-,检验其中一种离子的方法是用洁净的铂丝或铁丝蘸取粗产品在火焰上灼烧,若火焰呈黄色,证明有Na+;或 取粗产品少许,加水配成溶液,加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,证明有Cl-.
(4)为了洗涤所得的硝酸钾晶体,下列溶剂可用作洗涤剂的是bc(填编号).
a.热水 b.冰水 c.95%的酒精 d.四氯化碳
(5)如取34.0g硝酸钠和29.8g氯化钾,加入70g水,在100℃蒸发掉50g水,维持该温度,过滤,析出晶体的质量为15.58g.
| A. | v(O2)=0.125mol•(L•s)-1 | B. | v(NO)=0.01mol•(L•s)-1 | ||
| C. | v(NH3)=0.01 mol•(L•s)-1 | D. | v(NH3)=0.2 mol•(L•s)-1 |
| A. | 热稳定性:Na2CO3比NaHCO3稳定 | |
| B. | 溶解性:NaHCO3比Na2CO3易溶于水 | |
| C. | 相同质量的Na2CO3和NaHCO3分别与足量HCl反应,Na2CO3放出CO2少 | |
| D. | 相同物质的量浓度的Na2CO3和NaHCO3溶液分别与同浓度的盐酸反应,产生气体的速率Na2CO3小 |
| A. | 硅是人类将太阳能转换为电能的常用材料 | |
| B. | 粗硅制备单晶硅不涉及氧化还原反应 | |
| C. | 反应:Si+2NaOH+H2O═Na2SiO3+2H2↑中,Si为还原剂,NaOH和H2O为氧化剂 | |
| D. | 硅能与氢氟酸反应,则硅可以与盐酸反应 |
| 元素 | 相关信息 |
| X | X是形成化合物种类最多的元素,其中一种单质是自然界最硬的物质 |
| Y | Y的气态氢化物能使湿润的红色石蕊试纸变蓝 |
| Z | Z的基态原子的最外层电子排布式为ns2np4 |
| W | W的一种核素的质量数为57,中子数为31 |
(2)Z的第一电离能比Y的小(填“大”或“小”);XZ2是一种常用的溶剂,XZ2分子中σ键和π键的个数比为1:1;Y的气态氢化物比Z的气态氢化物更易溶于水,其主要原因是NH3与水分子间能形成氢键,而H2S与水分子间不能形成氢键.
(3)WZ2在空气中煅烧生成W2O3的化学方程式是4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
(4)汽车尾气中含有XO、YO,在汽车排气管中装有某种催化剂能使它们转化为单质Y.已知:2XO(g)+O2(g)═2XO2(g)△H=-566.0kJ•mol-1;Y2(g)+O2(g)═2YO(g)△H=180.0kJ•mol- 1此反应的热化学方程式是2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=-746.0kJ•mol-1.
| A. | 氯原子的结构示意图: | |
| B. | 作为相对原子质量测定标准的碳核素:614C | |
| C. | CCl4的电子式 | |
| D. | 氯化镁的电子式: |
| 选项 | 实验操作 | 实验目的 |
| A | 向醋酸溶液中加入少量石灰石固体 | 验证醋酸与碳酸的酸性强弱 |
| B | 在淀粉溶液中加入20%的稀H2SO4水解后,立即加入银氨溶液做银镜反应实验 | 验证淀粉水解是否有葡萄糖生成 |
| C | 在CuSO4溶液中加入过量NaOH溶液振荡,立即加入某同学尿液并加热 | 验证该同学是否患有糖尿病 |
| D | 在乙醇溶液中插入一根灼热变黑的铜丝 | 验证乙醇是否被氧化成醛 |
| A. | A | B. | B | C. | C | D. | D |