题目内容
19.反应4NH3+5O2?4NO+6H2O在一定体积的密闭容器中进行,30s后NO的物质的量浓度增加了3mol/L,则下列反应速率正确的是( )| A. | v(O2)=0.125mol•(L•s)-1 | B. | v(NO)=0.01mol•(L•s)-1 | ||
| C. | v(NH3)=0.01 mol•(L•s)-1 | D. | v(NH3)=0.2 mol•(L•s)-1 |
分析 根据化学反应速率的定义和化学反应速率之比等化学计量数之比进行计算.
解答 解:4NH3+5O2???4NO+6H2O,v(NO)=$\frac{△c}{△t}$=$\frac{3mol/L}{30s}$=0.1 mol•(L•s)-1;
A.v(NO):v(O2)=4:5,故v(O2)=$\frac{5}{4}$v(NO)=0.125 mol•(L•s)-1,故A正确;
B.v(NO)=0.1 mol•(L•s)-1,故B错误;
C.v(NO):v(NH3)=1:1,故v(NH3)=v(NO)=0.1 mol•(L•s)-1,故C错误;
D.v(NH3)=0.1 mol•(L•s)-1,故D错误;
故选A.
点评 本题考查化学反应速率的相关计算,把握化学反应速率的定义和化学反应速率之比等化学计量数之比为解答的关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.下列反应中,水只作为氧化剂的是( )
| A. | CaO+H2O═Ca(OH)2 | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | C+H2O═CO+H2 | D. | Cl2+H2O═HCl+HClO |
14.少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率可以使用如下方法( )
| A. | 加H2O | B. | 加入饱和食盐水 | ||
| C. | 增大压强 | D. | 升高温度(不考虑盐酸挥发) |
4.下列实验操作能达到预期目的是( )
| A. | 配制银氨溶液:向稀的AgNO3溶液中逐滴加入稀氨水至刚好生成沉淀 | |
| B. | 除去苯中的少量苯酚:加入浓溴水然后过滤 | |
| C. | 除去乙酸乙酯中的少量乙酸:加入饱和碳酸钠溶液,充分振荡,静置分液,弃水层 | |
| D. | 检验溴乙烷中的溴:将溴乙烷与NaOH溶液共热后冷却,再滴加AgNO3溶液 |
8.下列有关实验操作及说法正确的是( )
| A. | 准确称取0.4000g的NaOH固体配成1000mL浓度为0.01000 mol•L-1的溶液 | |
| B. | 用硫粉覆盖地下撒有的汞;用热碱溶液洗去试管内壁的硫;用二氧化碳扑灭金属钠引起的失火;用湿润的红色石蕊试纸检验氨气是否集满;以上操作均合理 | |
| C. | 用激光笔鉴别Fe(OH)3胶体和Fe(SCN)3溶液 | |
| D. | SO2溶于水,其水溶液能导电,说明SO2是电解质 |
9.在密闭容器中进行下列反应:M(g)+N(g)?R(g)+2L此反应符合如图,下列叙述正确的是( )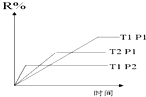

| A. | 正反应吸热,L是气体 | B. | 正反应吸热,L是固体 | ||
| C. | 正反应放热,L是气体 | D. | 正反应放热,L是固体 |

 ,NaClO溶液可用Cl2与NaOH溶液反应获得,写出该反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O
,NaClO溶液可用Cl2与NaOH溶液反应获得,写出该反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O