题目内容
根据下列物质的性质,判断其应用错误的是( )
| A、碳酸钠溶液呈碱性,可用于清洗油污 |
| B、水与乙醇以任意比例互溶,可用水洗、分液的方法除去溴乙烷中的乙醇 |
| C、镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 |
| D、游泳池中常加入硫酸铜,其主要作用是铜离子水解生成Cu(OH)2胶体,能吸咐池中的悬浮物 |
考点:盐类水解的应用,合金的概念及其重要应用,铜金属及其重要化合物的主要性质,物质的分离、提纯和除杂
专题:化学应用
分析:A、油污在碱性环境下水解会更加彻底,据此回答;
B、用作萃取剂的物质不能和原溶剂互溶;
C、根据储氢的原理来回答;
D、氢氧化铜不具有吸附作用,不做净水剂.
B、用作萃取剂的物质不能和原溶剂互溶;
C、根据储氢的原理来回答;
D、氢氧化铜不具有吸附作用,不做净水剂.
解答:
解:A、碳酸钠溶液呈碱性,油污在碱性环境下水解可得到易溶物,据此,碳酸钠溶液可以用于清洗油污,应用正确,故A错误;
B、水与乙醇以任意比例互溶的,溴乙烷和水是互不相溶的,可用水洗、再分液的方法除去溴乙烷中的乙醇,应用正确,故B错误;
C、镧镍合金能大量吸收H2形成金属氢化物,较稳定,便于储存,应用正确,故C错误;
D、氢氧化铝、氢氧化铁胶体,能吸咐池中的悬浮物,具有净水的作用,但是氢氧化铜不具有吸附作用,不能净水,应用错误,故D正确.
故选D.
B、水与乙醇以任意比例互溶的,溴乙烷和水是互不相溶的,可用水洗、再分液的方法除去溴乙烷中的乙醇,应用正确,故B错误;
C、镧镍合金能大量吸收H2形成金属氢化物,较稳定,便于储存,应用正确,故C错误;
D、氢氧化铝、氢氧化铁胶体,能吸咐池中的悬浮物,具有净水的作用,但是氢氧化铜不具有吸附作用,不能净水,应用错误,故D正确.
故选D.
点评:本题涉及物质的性质和应用等知识,注意知识的迁移和应用是关键,难度中等.

练习册系列答案
相关题目
离子晶体不可能具有的性质是( )
| A、较高的熔、沸点 |
| B、良好的导电性 |
| C、溶于极性溶剂 |
| D、坚硬而易粉碎 |
下列关于溶液中离子的说法正确的是( )
| A、0.1 mol?L-1的Na2CO3溶液中离子浓度关系:c (Na+)=2c (CO32-)+c (HCO3-)+c (H2CO3) |
| B、0.1 mol?L-1的NH4Cl和0.1 mol?L-1的NH3?H2O等体积混合后溶液中的离子浓度关系:c (Cl-)>c (NH4+)>c (H+)>c (OH-) |
| C、常温下,醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中,离子浓度关系:c (Na+)>c (CH3COO-) |
| D、0.1 mol?L-1的NaHS溶液中离子浓度关系:c (OH-)=c (H+)-c (S2-)+c (H2S) |
 为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的l6种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中正确的是( )
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的l6种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中正确的是( )| A、该物质可以视为酚类 |
| B、在浓硫酸作用下,分子内消去一个水分子只生成一种有机产物 |
| C、能使溴的四氯化碳溶液褪色 |
| D、该物质分子中的所有碳原子均共面 |
两种气态烃组成的混合物共0.1mol,完全燃烧后得到4.48LCO2(标准状况下)和3.6g水,则这两种气体可能是( )
| A、CH4和C3H8 |
| B、CH4和C3H4 |
| C、C2H4和C3H4 |
| D、C2H4和C2H6 |
下列离子方程式正确的是( )
| A、在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7:Ba2++OH-+H++SO42-→BaSO4↓+H2O |
| B、将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O→SO32-+2HClO |
| C、硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2→2 Fe3++2H2O |
| D、向NaHCO3 溶液中加入过量Ca(OH)2 溶液:2HCO3-+Ca2++2OH-→2H2O+CaCO3↓+CO32- |
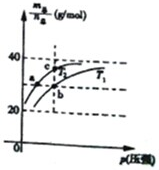 已知N2O4(g)?2NO2(g)△H>0且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强变化曲线如图所示,下列说法正确的是( )
已知N2O4(g)?2NO2(g)△H>0且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强变化曲线如图所示,下列说法正确的是( )| A、平衡常数K(a)=K(b)<K(c) | ||
| B、反应速率:va<vb | ||
| C、温度:T2>T1 | ||
D、当
|
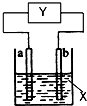 如图装置中a为纯铜棒,Y为电路的未知部分,X为某种液体,下列说法正确的是( )
如图装置中a为纯铜棒,Y为电路的未知部分,X为某种液体,下列说法正确的是( )