题目内容
10.霞石是一种硅酸盐,其组成可表示为K2O•3Na20•4Al2O3•8SiO2,某小组同学设计以霞石为原料制备Al2O3的方案如图:
请回答下列问题:
(1)沉淀1的化学式为SiO2.
(2)滤液1与过量NaOH溶液反应的所有的离子方程式为H++OH-=H2O、Al3++4OH-=AlO2-+2H2O.
(3)写出由溶液2生成Al(OH)3离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(4)通入过量的二氧化碳,过滤后的滤液中含有的阴离子主要是Cl-、HCO3-.
(5)由Al(OH)3→Al2O3的反应条件为加热.
(6)某同学提出上述流程较烦琐,可简化流程,其方法是向滤液1中加入足量的试剂X即可得到Al(OH)3,则试剂X为氨水.
分析 (1)由霞石为原料制备Al2O3的方案可知,霞石中加盐酸,只有二氧化硅不反应,则沉淀I为SiO2;
(2)根据滤液1中含氯化钾、氯化钠、氯化铝、HCl,再加过量的NaOH,除发生酸碱中和,NaOH还与氯化铝反应生成偏铝酸钠;
(3)溶液2中再通入二氧化碳,偏铝酸钠与过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠;
(4)溶液2中除生成碳酸氢钠,原过量的NaOH也能与过量二氧化碳反应生成碳酸氢钠,另外最初的滤液1中本身已经含有的阴离子是氯离子,由此分析可知滤液里主要含有的阴离子;
(5)Al(OH)3不稳定,受热易分解;
(6)Al(OH)3是两性氢氧化物,既能与酸反应,又能与碱反应,但弱酸如碳酸、弱碱如NH3•H2O不能溶解,再结合Al3+必须在碱性条件下才能生成Al(OH)3,即可确定应选择的试剂.
解答 解:由霞石为原料制备Al2O3的方案可知,霞石中加盐酸,只有二氧化硅不反应,则沉淀I为SiO2,滤液I中含氯化钾、氯化钠、氯化铝、HCl,再加过量的NaOH,发生酸碱中和、氯化铝与NaOH反应生成偏铝酸钠,再通入二氧化碳,偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀,过滤后加热氢氧化铝可制备氧化铝.
(1)由上述分析可知,沉淀I为SiO2,故答案为:SiO2;
(2)向滤液1中加入过量NaOH溶液的有关反应离子方程式为H++OH-=H2O、Al3++4OH-=AlO2-+2H2O或Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,故答案为:H++OH-=H2O、Al3++4OH-=AlO2-+2H2O或Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O;
(3)由溶液2生成Al(OH)3的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)滤液里主要的阴离子,可结合滤液1中本身含有的氯离子,以及通入过量CO2后生成的,故答案为:Cl-、HCO3-;
(5)Al(OH)3受热易分解,选择加热可使Al(OH)3分解生成Al2O3,故答案为:加热;
(6)向滤液1中加入足量的试剂X即可得到Al(OH)3,应选择弱碱,试剂X为氨水,故答案为:氨水.
点评 本题考查无机物制备实验方案的设计,把握制备流程中的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意氢氧化铝的两性,中等难度.

| A. | 中子数为18的氯原子:${\;}_{17}^{35}$Cl | B. | 二氧化碳分子的比例模型: | ||
| C. | HClO的电子式: | D. | 对羟基苯甲醛的结构简式:OH- -CHO -CHO |
| A. |  | B. | 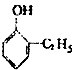 | C. |  | D. | 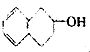 |
(1)硫酸是基础化学工业的重要产品,下列为接触法制硫酸的反应:
4FeS2(s)+11O2(g)$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g)△H=-3412kJ•mol-1
2SO2(g)+O2(g)$\stackrel{催化剂}{?}$2SO3(g)△H=-196.6kJ•mol-1
SO3(g)+H2O(l)═H2SO4(l)△H=-130.3kJ•mol-1
理论上,用FeS2为原料生产2mol H2SO4(I)所释放的热量为1310.2kJ•mol-1
(2)硫酸生产过程中会产生硫酸渣,其成分主要为:Fe(约55%)、CaO和CaS(约16%)、SiO2(约11%)、MgO(约6%)、Al2O3(约10%),一种利用硫酸渣制备绿矾(FeSO4•7H2O)的工艺流程如下:

表:几种离子沉淀pH 粗制FeSO4晶体
| 开始沉淀的pH | 沉淀完全的pH | |
| Al3+ | 3.2 | 4.4 |
| Fe2+ | 6.3 | 8.4 |
| Ca2+ | 11.8 | \ |
| Mg2+ | 8.8 | 10.8 |
①上述流程中加入铁屑时反应的离子方程式Fe+2H+=H2↑+Fe2+,Fe+2Fe3+=3Fe2+.
②上述制备过程中加入CaO调节pH=4.5时,产生沉淀的主要成分为Al(OH)3.
③精制FeSO4•7H2O前,需向滤液中加入H2SO4调节pH,其目的是抑制Fe2+离子的水解.
④研究发现,其他条件相同,结晶温度在70℃左右时硫酸亚铁纯度最高,分析大于70℃时,硫酸亚铁纯度降低的主要原因可能为可能是亚铁离子被氧化为铁离子的量增多.
(3)H2S是一种无色、有毒且有恶臭味的气体.煤的低温焦化,含硫石油开采、提炼,橡胶、制革、染料、制糖等工业中都有H2S产生,有研究组设计了一种硫化氢-空气染料电池,总反应为2H2S+O2═2S+2H2O,简易结构如图所示:

①硫化氢应通入到电极b.(填“a”或“b”)
②b极发生的电极反应式为H2S-2e-+O2-=S↓+H2O.
 氢化钙(CaH2)是二种常用的储氢材料,也是登山运动员常用的能源提供剂,需要密封保存,遇水反应生成氢氧化钙和氢气.•某研究性学习小组模拟生产企业制取氢化钙
氢化钙(CaH2)是二种常用的储氢材料,也是登山运动员常用的能源提供剂,需要密封保存,遇水反应生成氢氧化钙和氢气.•某研究性学习小组模拟生产企业制取氢化钙【实验】
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2.
(1)下列有关该实验的说法正确的是acd.
a其他条件相同时,粗锌制取氢气的速率比纯锌快
b•加热时,必须通人氮气作为保护气,以防止空气的干扰
c可以用浓硫酸或碱石灰对H2进行干燥除杂
d•开始实验时,应先通人H2,后给金属钙加热
已停止实验时,应先停止通人H2,后停止加热•
【提出假设】
(2)由于实验中操作不当,金属钙或氢化钙都可能被氧化;该小组甲同学对反应后的固体产物成分提出如下假设.
假设l:含有Ca 和CaH2.
假设2:含有CaH2和CaO.
假设3:含有Ca、CaH2、CaO.
【设计实验方案,验证假设】
(3)定性实验用化学方法鉴别Ca与CaH2,请设计实验完成下表中内容.
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| 取少量固体样品,•… |
①取m1g样品与水完全反应,利用如图装置测定生成的气体体积时,在a时进行收集(填字母)
a刚开始有气泡时
b气泡连续均匀时
c气体经过验纯后,再收集
②如果装置气密性良好,操作正确,乙同学认为:由于液体加入,导致气体的体积测定偏大,则计算出氢化钙的质量分数偏高(天“偏高”、“偏低”“无影响”)
【反思与交流】
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便.既然金属钙与水反应也能生成氢气,为什么还要讲金属钙制备成氢化钙呢?你的观点是等质量的钙与氢化钙中,氢化钙产生成氢气多.
| A. | 1.4mol | B. | 1.6mol | C. | 1.8mol | D. | 2.0mol |
| A. | ${\;}_{24}^{52}$Cr | B. | ${\;}_{12}^{24}$Mg | C. | ${\;}_{26}^{56}$Fe | D. | ${\;}_{22}^{48}$Ti |
