题目内容
有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38.Y元素原子最外层电子数占核外总电子数的3/4;W元素原子最外层电子比同周期Z元素多5个电子;W和Y不属同一主族.
(1)写出元素符号:X ,Y ,Z ,W .
(2)Z、W两元素最高价氧化物对应水化物反应的方程式是 .
(3)把Z的单质(片状)放入滴有酚酞的沸水中,现象是 反应的化学方程式是 .
(1)写出元素符号:X
(2)Z、W两元素最高价氧化物对应水化物反应的方程式是
(3)把Z的单质(片状)放入滴有酚酞的沸水中,现象是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W四种短周期元素,原子序数依次增大,由Y元素原子最外层电子数占核外总电子数的
,最外层电子数不超过8,故核外电子总数小于11,且为4的倍数,核外总电子为8符合,则最外层电子数为6,即Y为氧元素;W和Y不属于同一主族,W元素原子最外层电子数比同周期Z元素原子最外层电子数多5个电子,则W处于ⅦA族,Z处于ⅡA族,Z原子序数大于氧元素,则W、Z处于第三周期,故W为氯,Z为镁;四元素核电荷数总和为38,X的核电荷数为38-8-12-17=1,则X为氢元素,据此解答.
| 3 |
| 4 |
解答:
解:X、Y、Z、W四种短周期元素,原子序数依次增大,由Y元素原子最外层电子数占核外总电子数的
,最外层电子数不超过8,故核外电子总数小于11,且为4的倍数,核外总电子为8符合,则最外层电子数为6,即Y为氧元素;W和Y不属于同一主族,W元素原子最外层电子数比同周期Z元素原子最外层电子数多5个电子,则W处于ⅦA族,Z处于ⅡA族,Z原子序数大于氧元素,则W、Z处于第三周期,故W为氯,Z为镁;四元素核电荷数总和为38,X的核电荷数为38-8-12-17=1,则X为氢元素,
(1)由上述分析可知,X为H、Y为O、Z为Mg、W为Cl,故答案为:H;O;Mg;Cl;
(2)Mg元素的最高价氧化物的对应水化物为Mg(OH)2,Cl元素的最高价氧化物的水化物为HClO4,酸碱反应生成盐和水,则反应为Mg(OH)2+2HClO4=Mg(ClO4)2+2H2O,故答案为:Mg(OH)2+2HClO4=Mg(ClO4)2+2H2O;
(3)Z的单质为镁,在沸水中与水反应生成氢氧化镁和氢气,氢氧化镁身微溶于热水,能使酚酞变红,反应的化学方程式为是Mg+2H2O=Mg(OH)2+H2↑,
故答案为:溶液变红色、有气泡;Mg+2H2O=Mg(OH)2+H2↑.
| 3 |
| 4 |
(1)由上述分析可知,X为H、Y为O、Z为Mg、W为Cl,故答案为:H;O;Mg;Cl;
(2)Mg元素的最高价氧化物的对应水化物为Mg(OH)2,Cl元素的最高价氧化物的水化物为HClO4,酸碱反应生成盐和水,则反应为Mg(OH)2+2HClO4=Mg(ClO4)2+2H2O,故答案为:Mg(OH)2+2HClO4=Mg(ClO4)2+2H2O;
(3)Z的单质为镁,在沸水中与水反应生成氢氧化镁和氢气,氢氧化镁身微溶于热水,能使酚酞变红,反应的化学方程式为是Mg+2H2O=Mg(OH)2+H2↑,
故答案为:溶液变红色、有气泡;Mg+2H2O=Mg(OH)2+H2↑.
点评:本题主要考查了元素化合物的知识,难度不大,解题的关键在于元素推断,解题时注意化学用语的规范表达.

练习册系列答案
相关题目
大量事实证明,水溶液中并不存在H+、AlO2-等离子,实际存在的是H30+、[Al(OH)4]-.铝和强碱溶液的反应可以理解为铝在碱性环境下先与水反应,而后进一步与强碱反应(反应均不可逆).对于Al与重氢氧化钠(NaOD)的水溶液反应(假定水中不含氘和氚),下列说法正确的是( )
| A、生成的氢气中只含有D2 |
| B、生成的氢气中只含有H2 |
| C、生成的氢气中含有H2、HD、D2 |
| D、以上判断都不正确 |
如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )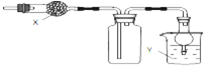

| A、X是碱石灰,收集到的气体是氯化氢,Y是水 |
| B、X是碱石灰,收集到的气体是氨气,Y是水 |
| C、X是氯化钙,搜集到的气体是二氧化硫,Y是氢氧化钠 |
| D、X是氯化钙,收集到的气体是一氧化氮,Y是氢氧化钠 |
关于Na2O和 Na2O2的叙述中错误的是( )
| A、Na2O是白色固体,Na2O2是淡黄色固体 |
| B、两物质都是碱性氧化物,其中氧元素的化合价都是-2价 |
| C、两者都能和水、二氧化碳、盐酸发生反应 |
| D、Na2O2比Na2O稳定,Na2O在一定条件下可转化为Na2O2 |
下列溶液中含3种分子的是( )
| A、氯水 | B、溴的四氯化碳溶液 |
| C、醋酸溶液 | D、酒精水溶液 |