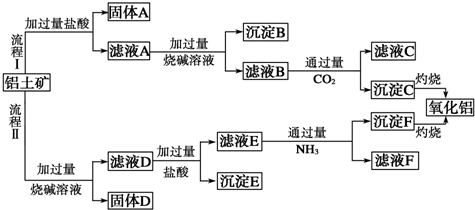
题目内容
用含少量铁的氧化铜制取氯化铜晶体(CuCl2?xH2O).有如下操作:
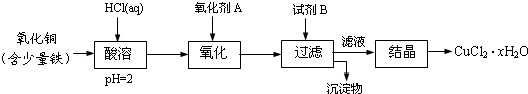
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解.
(1)氧化剂A可选用 (填编号,下同)
①Cl2 ②KMnO4 ③HNO3 ④H2O2
(2)要得到较纯的产品,试剂B可选用 .
①NaOH ②FeO ③CuO ④Cu2(OH)2CO3
(3)试剂B的作用是 .
①提高溶液的pH ②降低溶液的pH ③使Fe3+完全沉淀 ④使Cu2+完全沉淀
(4)从滤液经过结晶得到氯化铜晶体的方法是 (按实验先后顺序选填编号)
①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
(5)为了测定制得的氯化铜晶体(CuCl2?xH2O)中x值,某兴趣小组设计了两种实验方案:
方案一:称取m g晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n g.
方案二:称取m g晶体、加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止、冷却、称量所得固体的质量为ng.
试评价上述两种实验方案,其中正确的方案是 ,据此计算得x= (用含m、n的代数式表示).

已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解.
(1)氧化剂A可选用
①Cl2 ②KMnO4 ③HNO3 ④H2O2
(2)要得到较纯的产品,试剂B可选用
①NaOH ②FeO ③CuO ④Cu2(OH)2CO3
(3)试剂B的作用是
①提高溶液的pH ②降低溶液的pH ③使Fe3+完全沉淀 ④使Cu2+完全沉淀
(4)从滤液经过结晶得到氯化铜晶体的方法是
①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
(5)为了测定制得的氯化铜晶体(CuCl2?xH2O)中x值,某兴趣小组设计了两种实验方案:
方案一:称取m g晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n g.
方案二:称取m g晶体、加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止、冷却、称量所得固体的质量为ng.
试评价上述两种实验方案,其中正确的方案是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:向固体中加入盐酸,盐酸和铁、氧化铜反应,发生的离子反应方程式为:Fe+2H+=Fe2++H2↑;CuO+2H+=Cu2++H2O,加入氧化剂A的目的是把亚铁离子氧化,根据除杂原则,不能引入新的杂质;加入试剂B的目的是调节pH使铁离子生成氢氧化铁沉淀,过滤除去沉淀,对滤液进行蒸发浓缩、冷却结晶、过滤得到氯化铜晶体.
(1)加入氧化剂,将Fe2+氧化为Fe3+,易除去,除杂时,不能引入新的杂质;
(2)在制取过程中,不能引进杂质离子,据此来选择合适的试剂;
(3)加入盐酸时,盐酸是过量的,导致溶液酸性较强,溶液酸性较强则铁离子不沉淀,为使铁离子沉淀则应提高溶液的pH;
(4)根据溶液获得晶体的方法来回答;
(5)CuCl2?xH2O晶体加热时会发生水解;加热沉淀至质量不再减轻为止,ng为CuO质量,根据铜元素守恒可知,n(CuO)=n(CuCl2?xH2O),再结合m=nM计算x的值.
(1)加入氧化剂,将Fe2+氧化为Fe3+,易除去,除杂时,不能引入新的杂质;
(2)在制取过程中,不能引进杂质离子,据此来选择合适的试剂;
(3)加入盐酸时,盐酸是过量的,导致溶液酸性较强,溶液酸性较强则铁离子不沉淀,为使铁离子沉淀则应提高溶液的pH;
(4)根据溶液获得晶体的方法来回答;
(5)CuCl2?xH2O晶体加热时会发生水解;加热沉淀至质量不再减轻为止,ng为CuO质量,根据铜元素守恒可知,n(CuO)=n(CuCl2?xH2O),再结合m=nM计算x的值.
解答:
解:(1)根据题意,加入氧化剂A可把Fe2+氧化为Fe3+,而没有增加新杂质,所以A为H2O2,或是Cl2,故答案为:①④;
(2)得到较纯的产品,试剂可选用CuO或Cu2(OH)2CO3,①②均会引入杂质离子,故答案为:③④;
(3)溶液酸性较强则铁离子不沉淀,为使铁离子沉淀则应提高溶液的pH,故选①③;故答案为:①③;
(4)从滤液经过结晶得到氯化铜晶体,首先要加热蒸发浓缩,冷却后,再将之过滤即可,故答案为:②④①;
(5)CuCl2?xH2O晶体加热时会发生水解CuCl2+2H2O?Cu(OH)2+2HCl,有HCl气体放出,CuCl2质量偏小,测得x值偏大,
所以选择方案二,氯化铜和氢氧化钠反应生成氢氧化铜沉淀,加热沉淀,氢氧化铜分解生成氧化铜,则ng为CuO质量,物质的量为:
=
mol,根据铜元素守恒可知,n(CuO)=n(CuCl2?xH2O),所以mg=
mol×(135+18x)g/mol,解得,x=
.
故答案为:二;
.
(2)得到较纯的产品,试剂可选用CuO或Cu2(OH)2CO3,①②均会引入杂质离子,故答案为:③④;
(3)溶液酸性较强则铁离子不沉淀,为使铁离子沉淀则应提高溶液的pH,故选①③;故答案为:①③;
(4)从滤液经过结晶得到氯化铜晶体,首先要加热蒸发浓缩,冷却后,再将之过滤即可,故答案为:②④①;
(5)CuCl2?xH2O晶体加热时会发生水解CuCl2+2H2O?Cu(OH)2+2HCl,有HCl气体放出,CuCl2质量偏小,测得x值偏大,
所以选择方案二,氯化铜和氢氧化钠反应生成氢氧化铜沉淀,加热沉淀,氢氧化铜分解生成氧化铜,则ng为CuO质量,物质的量为:
| ng |
| 80g/mol |
| n |
| 80 |
| n |
| 80 |
| 80m-135n |
| 18n |
故答案为:二;
| 80m-135n |
| 18n |
点评:本题考查阅读获取信息能力、对工艺流程理解与实验条件控制、实验方案的评价、化学计算、物质分离提纯除杂等有关实验操作以及在新情境下综合运用知识解决问题的能力.题目难度中等,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,注意基础知识的全面掌握.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、H2、2H、H+是三种不同的核素 |
| B、3He和4He互为同位素 |
| C、14C和14N互为同素异形体 |
| D、元素的种类多于核素的种类 |
下列有机物,能发生消去反应生成2种烯烃,又能发生水解反应的是( )
| A、1-溴丁烷 |
| B、2,2-二甲基-3-溴丁烷 |
| C、3-氯戊烷 |
| D、2-甲基-3-氯戊烷 |
以下是一些常用的危险品标志,装运酒精的包装箱应贴的图标是( )
A、 |
B、 |
C、 |
D、 |
某同学探究氨和铵盐的性质,相关实验操作及现象描述正确的是( )
| A、加热NH4Cl晶体制备氨气 |
| B、将蘸有浓氨水和浓硝酸的玻璃棒靠近,观察到白烟 |
| C、将氨水缓慢滴入AlCl3溶液中,研究Al(OH)3的两性 |
| D、室温下测定等浓度氨水和NaOH溶液的pH,比较N和Na的金属性强弱 |