题目内容
下述实验能达到预期目的是( )
| A、用润湿的pH试纸测定饱和Na2CO3溶液的pH |
| B、向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积比较两种酸的电离程度:醋酸<盐酸 |
| C、将1mLKSCN溶液与1mL同浓度FeCl3溶液充分混合;再继续加入KSCN溶液,溶液颜色加深.证明溶液中存在平衡:Fe3++3SCN-═Fe(SCN)3 |
| D、在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的冷却温度作为终点温度 |
考点:化学实验方案的评价,中和热的测定
专题:实验评价题
分析:A.用润湿的pH试纸测定pH易导致误差;
B.醋酸为弱酸,不能完全电离,同pH时,醋酸浓度大;
C.KSCN溶液不足,不能证明存在平衡;
D.将氢氧化钠溶液和盐酸混合反应后的最高温度作为末温度.
B.醋酸为弱酸,不能完全电离,同pH时,醋酸浓度大;
C.KSCN溶液不足,不能证明存在平衡;
D.将氢氧化钠溶液和盐酸混合反应后的最高温度作为末温度.
解答:
解:A.用润湿的pH试纸测定pH,会导致溶液浓度减小,导致误差,故A错误;
B.醋酸为弱酸,不能完全电离,同pH时,醋酸浓度大,等体积时生成气体多,可通过生成气体的体积判断两种酸的电离度,故B正确;
C.KSCN溶液不足,不能证明存在平衡,应使二者恰好反应后再检验,故C错误;
D.中和热是要求酸碱中和反应的放热量,用反应的最高温度为末温度,溶液初始温度为初温度,初末温度做差,再利用溶液的比热容、溶质摩尔数等代入计算公式,可以求得反应的中和热,故D错误.
故选B.
B.醋酸为弱酸,不能完全电离,同pH时,醋酸浓度大,等体积时生成气体多,可通过生成气体的体积判断两种酸的电离度,故B正确;
C.KSCN溶液不足,不能证明存在平衡,应使二者恰好反应后再检验,故C错误;
D.中和热是要求酸碱中和反应的放热量,用反应的最高温度为末温度,溶液初始温度为初温度,初末温度做差,再利用溶液的比热容、溶质摩尔数等代入计算公式,可以求得反应的中和热,故D错误.
故选B.
点评:本题考查化学实验方案的评价,侧重于试纸的使用、弱电解质的电离、平衡移动以及中和热测定等,题目难度不大,注意把握相关物质的性质.

练习册系列答案
 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
相关题目
将一定质量和钠投入24.6g水中,形成t°C的NaOH饱和溶液31.2g,t°C时,NaOH的溶解度为( )
| A、48g | B、62.5g |
| C、23g | D、31g |
下列化学用语或模型正确的是( )
| A、乙烯的结构简式:CH2CH2 |
B、甲烷分子的比例模型: |
C、羟基的电子式: |
| D、葡萄糖的最简式:C6H12O6 |
下列有关实验说法不正确的是( )
| A、在用简易量热计测定反应热时,可使用碎泡沫起隔热保温作用、环形玻璃搅拌棒进行搅拌使其充分反应、读取反应中温度计的最高温度、取2-3 次的实验平均值,以达到良好的实验效果 |
| B、纸上层析属于色谱分析法,其原理仅和“毛细现象”相关 |
| C、向1mL0.5mol?L-1AlCl3溶液中滴加2mL饱和NaF溶液,再滴加1mL 3.0mol?L-1 NH3?H2O溶液,无沉淀生成,说明Al3+更易与F-结合成AlF63-- |
| D、为了使过饱和溶液中析出晶体,可用玻璃棒摩擦与溶液接触处的试管壁 |
 氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.
氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.
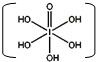 和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6
和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6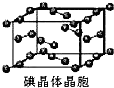 A、用均摊法可知平均每个晶胞中有4个碘原子
A、用均摊法可知平均每个晶胞中有4个碘原子