题目内容
13.下列关于反应能量的说法正确的是( )| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
分析 A、当反应物总能量>生成物总能量,则反应是放热反应;
B、物质的能量越低越稳定,形成化学键过程是放热过程;
C、燃烧热必须是1mol物质燃烧生成最稳定的氧合物所放出的能量;
D、中和热是强酸和强碱发生中和反应生成1mol水时,所放出的热量.
解答 解:A、当反应物总能量>生成物总能量,则反应是放热反应,△H<O,故A正确;
B、如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2.原子的能量比分子的能量高,所以原子灰结合成分子形成化学键放出热量,即2H=H2 放出热量,则2E1>E2,故B错误;
C、H2的燃烧热必须是1mol物质燃烧生成最稳定的氧合物液态水时所放出的能量,故C错误;
D、中和热是强酸和强碱的稀溶液发生中和反应生成1mol水时,所放出的热量,1molNaOH的氢氧化钠固体与含0.5molH2SO4的稀硫酸混合时,氢氧化钠固体溶于水放热,所以导致△H<-57.3kJ•mol-1,故D错误.
故选A.
点评 本题考查化学反应中的能量变化的有关知识,主要是反应的能量守恒的应用,形成化学键是放热反应,燃烧热、中和热的概念应用,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
3.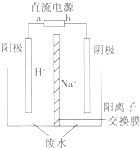 为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2?CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.
为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2?CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.
(1)实验1中,10h后反应达到平衡,则从反应开始至达到平衡状态,H2的平均反应速率为
0.06mol•L-1•h-1.在此实验的平衡体系中,再加入0.5mol CCl4和0.5mol HCl,平衡将怎样移动?向右移动 (填“向左移动”、“向右移动”、“不移动”或“无法确定”).
(2)实验2中,x为B(填字母).
A.等于50% B.大于50% C.小于50% D.无法确定
(3)实验3中的y为0.8.
(4)在100℃条件下,能说明反应CCl4+H2?CHCl3+HCl△H<O达到平衡状态的是D(填字母).
A.压强不再变化
B.生成HCl的速率和消耗H2的速率相等
C.混合气体的密度不变
D.H2的质量不再变化
(5)用电解法处理高浓度重铬酸钠废水具有效果稳定可靠,操作管理
简单,设备占地面积小,废水中的重金属离子也能通过电解有所降
低等优点,其原理是铁作电极,在酸性条件下,将Cr6+还原为Cr3+,
其装置示意图如图所示.
①若以甲醚燃料电池为直流电源(电解质溶液为KOH溶液),则燃料电池中b极应通入甲醚,a极的电极反应为13O2+52e-=26O2-.
②能否用铜作电解重铬酸钠废水的电极?不能(填“能”或“不能”),理由是铜做阳极时铜失电子为铜离子,铜离子不能与+6价铬发生氧化还原反应反应得到+3价铬
③除去重铬酸根离子的离子反应是Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
 为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2?CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.
为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2?CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.| 实验序号 | 温度℃ | 初始CCl4浓度(mol•L-1) | 初始H2浓度(mol•L-1) | CCl4的转化率 |
| 1 | 110 | 1 | 1 | 50% |
| 2 | 100 | 1 | 1 | x |
| 3 | 110 | 0.8 | y | 60% |
0.06mol•L-1•h-1.在此实验的平衡体系中,再加入0.5mol CCl4和0.5mol HCl,平衡将怎样移动?向右移动 (填“向左移动”、“向右移动”、“不移动”或“无法确定”).
(2)实验2中,x为B(填字母).
A.等于50% B.大于50% C.小于50% D.无法确定
(3)实验3中的y为0.8.
(4)在100℃条件下,能说明反应CCl4+H2?CHCl3+HCl△H<O达到平衡状态的是D(填字母).
A.压强不再变化
B.生成HCl的速率和消耗H2的速率相等
C.混合气体的密度不变
D.H2的质量不再变化
(5)用电解法处理高浓度重铬酸钠废水具有效果稳定可靠,操作管理
简单,设备占地面积小,废水中的重金属离子也能通过电解有所降
低等优点,其原理是铁作电极,在酸性条件下,将Cr6+还原为Cr3+,
其装置示意图如图所示.
①若以甲醚燃料电池为直流电源(电解质溶液为KOH溶液),则燃料电池中b极应通入甲醚,a极的电极反应为13O2+52e-=26O2-.
②能否用铜作电解重铬酸钠废水的电极?不能(填“能”或“不能”),理由是铜做阳极时铜失电子为铜离子,铜离子不能与+6价铬发生氧化还原反应反应得到+3价铬
③除去重铬酸根离子的离子反应是Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
4.下列表示对应化学反应的离子方程式正确的是( )
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向Na2SiO3溶液中通入少量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 铝粉投入NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| D. | AlCl3溶液中加入足量氨水:Al3++3OH-═Al(OH)3↓ |
8.常温下,下列物质既能使溴水褪色,又能使酸性高锰酸钾溶液褪色,并且化学反应原理相同的是( )
| A. | 乙烯 | B. | 二氧化硫 | C. | 氢气 | D. | 乙烷 |
18.将一小粒金属钠投入到盛有无水乙醇的小烧杯中,以下描述合理的是( )
| A. | 不反应 | B. | 烧杯内溶液颜色逐渐变红 | ||
| C. | 金属钠沉入烧杯底部,并产生气泡 | D. | 金属钠浮于液面上,四处游动 |
5.用图甲所示装置进行实验,若图乙中横坐标x表示流入电极的电子的物质的量.下列叙述错误的是( )


| A. | E表示反应生成NaOH的物质的量 | B. | E表示反应消耗H2O的物质的量 | ||
| C. | F表示反应生成H2或Cl2的物质的量 | D. | F表示反应消耗NaCl的物质的量 |
2.饱和食盐水露置在空气中一段时间后,有少量固体析出,这是因为( )
| A. | 氯化钠溶解度减小 | B. | 溶液中溶质的质量分数变小 | ||
| C. | 溶剂的质量减小 | D. | 溶液变成不饱和溶液 |
3.材料是人类赖以生存和发展的重要物质基础.有机高分子材料的出现是材料发展史上的一次重大突破.下更物质中含有有机高分子材料的是( )
| A. | 普通水泥 | B. | 普通玻璃 | C. | 汽车轮胎 |
