题目内容
在一密闭容器中充入1molH2和1molI2,压强为p(Pa),并在一定温度下使发生反应:I2(g)+H2(g)?2HI(g)△H<0.
(1)保持容器容积不变,向其中加入1molH2,反应速率 (填“增大”、“减小”或“不变”,下同);保持容器容积不变,向其中加入1molN2(N2不参加反应),反应速率 .
(2)保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),反应速率 ;保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),反应速率 .
(3)若容器体积为10L,反应达平衡时,测得c(H2)=0.08mol/L,则该反应的平衡常数K= .
(4)在上述温度下,该10L容器中若通入H2和I2蒸气各2mol,则达到平衡时c(H2)= .
(1)保持容器容积不变,向其中加入1molH2,反应速率
(2)保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),反应速率
(3)若容器体积为10L,反应达平衡时,测得c(H2)=0.08mol/L,则该反应的平衡常数K=
(4)在上述温度下,该10L容器中若通入H2和I2蒸气各2mol,则达到平衡时c(H2)=
考点:化学平衡的影响因素,化学反应速率的影响因素
专题:化学平衡专题,化学反应速率专题
分析:(1)保持容器容积不变,向其中加入1molH2,即增加了反应物浓度,反应速率增大,体积不变,加入氮气,有关反应的各物质的浓度不变,所以反应速率 不变;
(2)保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),容器体积增大,相当于减压,所以反应速率减小,保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),相当于反应物的物质的量为原来的2倍,体积也为原来的2倍,所以浓度没变,反应速率 不变;
(3)根据平衡常数的定义,利用三段式计算;
(4)利用平衡常数,利用三段式计算平衡时氢气的浓度.
(2)保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),容器体积增大,相当于减压,所以反应速率减小,保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),相当于反应物的物质的量为原来的2倍,体积也为原来的2倍,所以浓度没变,反应速率 不变;
(3)根据平衡常数的定义,利用三段式计算;
(4)利用平衡常数,利用三段式计算平衡时氢气的浓度.
解答:
解:(1)保持容器容积不变,向其中加入1molH2,即增加了反应物浓度,反应速率增大,体积不变,加入氮气,有关反应的各物质的浓度不变,所以反应速率 不变,故答案为:增大;不变;
(2)保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),容器体积增大,相当于减压,所以反应速率减小,保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),相当于反应物的物质的量为原来的2倍,体积也为原来的2倍,所以浓度没变,反应速率 不变,故答案为:减小;不变;
(3)容器体积为10L,所以氢气和碘的起始浓度分别为0.1mol/L、0.1mol/L,
I2(g)+H2(g)?2HI(g)
起始(mol/L) 0.1 0.1 0
转化(mol/L) 0.02 0.02 0.04
平衡(mol/L) 0.08 0.08 0.04
平衡常数K=
=0.25
故答案为:0.25;
(4)容器体积为10L,所以氢气和碘的起始浓度分别为0.2mol/L、0.2mol/L,设平衡时氢的浓度为x,
I2(g)+H2(g)?2HI(g)
起始(mol/L) 0.2 0.2 0
转化(mol/L) 0.2-x 0.2-x 0.4-2x
平衡(mol/L) x x 0.4-2x
因为K=
=0.25,所以x=0.16
故答案为:0.16mol/L.
(2)保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),容器体积增大,相当于减压,所以反应速率减小,保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),相当于反应物的物质的量为原来的2倍,体积也为原来的2倍,所以浓度没变,反应速率 不变,故答案为:减小;不变;
(3)容器体积为10L,所以氢气和碘的起始浓度分别为0.1mol/L、0.1mol/L,
I2(g)+H2(g)?2HI(g)
起始(mol/L) 0.1 0.1 0
转化(mol/L) 0.02 0.02 0.04
平衡(mol/L) 0.08 0.08 0.04
平衡常数K=
| 0.042 |
| 0.08×0.08 |
故答案为:0.25;
(4)容器体积为10L,所以氢气和碘的起始浓度分别为0.2mol/L、0.2mol/L,设平衡时氢的浓度为x,
I2(g)+H2(g)?2HI(g)
起始(mol/L) 0.2 0.2 0
转化(mol/L) 0.2-x 0.2-x 0.4-2x
平衡(mol/L) x x 0.4-2x
因为K=
| (0.4-2x)2 |
| x?x |
故答案为:0.16mol/L.
点评:本题主要考查了影响化学平衡移动的因素、化学平衡常数的计算、化学平衡常数的应用等知识点,难度不大,解题时注意基础知识的运用.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
下列离子方程式不正确的是( )
| A、Na2CO3溶液与足量盐酸反应:CO32-+2H+═CO2↑+H2O |
| B、FeCl2溶液和Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
| C、钠与水反应:Na+H2O═Na++OH-+H2↑ |
| D、NaHCO3溶液与NaOH溶液:HCO3-+OH-═CO32-+H2O |
在用0.1000mol/LNaOH溶液测定食醋总酸含量的实验中,下列说法正确的是( )
| A、碱式滴定管没有润洗会使测定含量偏低 |
| B、用移液管移取一定体积食醋时,应将移液管垂直放入稍倾斜的容器中,并将尖嘴贴紧容器 |
| C、该实验应用甲基橙作指示剂 |
| D、如果氢氧化钠溶液滴加过量,只能重新实验 |
 (1)硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一.
(1)硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一.
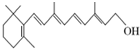 (1)如图的键线式表示维生素A的分子结构.
(1)如图的键线式表示维生素A的分子结构.