题目内容
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A、5.6g铁粉在0.1mol氯气中充分燃烧,转移电了数为0.3NA |
| B、7.8gNa2S和 Na2O2的固体混合物中含有的阴离子数大于0.1NA |
| C、50mL l8.4mol?L浓浓硫酸与足量铜加热反应,生成SO2分子的数日为0.46NA |
| D、常温常压下,46gNO2和N2O4的混合物中含有2NA个氧原子 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.先判断过量情况,然后根据不足量计算出转移的电子数;
B.过氧化钠和硫化钠的摩尔质量都是78g/mol,过氧化钠中阴离子为过氧根离子;
C.铜足量,随着反应的进行,浓硫酸变成稀硫酸时反应停止,则硫酸不会完全反应;
D.NO2和N2O4的最简式为NO2,根据最简式计算出混合物中含有的氧原子数目.
B.过氧化钠和硫化钠的摩尔质量都是78g/mol,过氧化钠中阴离子为过氧根离子;
C.铜足量,随着反应的进行,浓硫酸变成稀硫酸时反应停止,则硫酸不会完全反应;
D.NO2和N2O4的最简式为NO2,根据最简式计算出混合物中含有的氧原子数目.
解答:
解:A.5.6g铁的物质的量为0.1mol,0.1mol铁完全反应消耗0.15mol氯气,氯气不足,0.1mol氯气完全反应转移了0.2mol电子,转移电了数为0.2NA,故A错误;
B.7.8g硫化钠和过氧化钠混合物的物质的量为0.1mol,由于过氧化钠中阴离子为过氧根离子,则0.1mol混合物中含有0.1mol阴离子,含有的阴离子数为0.1NA,故B错误;
C.50mL l8.4mol/L的浓硫酸中含有硫酸0.92mol,消耗0.92mol硫酸会生成0.46mol二氧化硫,由于浓硫酸变成稀硫酸后,反应题中,则反应放出的二氧化硫小于0.46mol,生成SO2分子的数日为0.46NA,故C错误;
D.46gNO2和N2O4的混合物中含有1mol最简式为NO2,则该混合物中含有2mol氧原子,含有2NA个氧原子,故D正确;
故选D.
B.7.8g硫化钠和过氧化钠混合物的物质的量为0.1mol,由于过氧化钠中阴离子为过氧根离子,则0.1mol混合物中含有0.1mol阴离子,含有的阴离子数为0.1NA,故B错误;
C.50mL l8.4mol/L的浓硫酸中含有硫酸0.92mol,消耗0.92mol硫酸会生成0.46mol二氧化硫,由于浓硫酸变成稀硫酸后,反应题中,则反应放出的二氧化硫小于0.46mol,生成SO2分子的数日为0.46NA,故C错误;
D.46gNO2和N2O4的混合物中含有1mol最简式为NO2,则该混合物中含有2mol氧原子,含有2NA个氧原子,故D正确;
故选D.
点评:本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确分子、原子、原子核内质子中子及核外电子的构成关系,选项B为易错点,注意过氧化钠中的阴离子为过氧根离子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列实验能获得成功的是( )
| A、锌和稀硝酸反应制备氢气 |
| B、用铁粉、溴水和苯制取溴苯 |
| C、铝放入冷的浓硝酸中制取二氧化氮 |
| D、用亚硫酸钠与硫酸制取二氧化硫 |
同周期主族元素X、Y、Z,它们最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
| A、含氧酸的酸性H3ZO4>H2YO4>HXO4 |
| B、非金属性Z>Y>X |
| C、原子半径Z>Y>X |
| D、气态氢化物的稳定性按X、Y、Z的顺序增强 |
如图是某学校实验室买回的硫酸试剂标签的部分内容.判断下列说法正确的是( )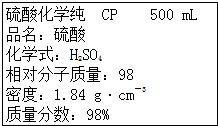

| A、该硫酸的浓度为9.2 mol?L-1 | ||
| B、配制200 mL 4.6 mol?L-1的稀H2SO4需该H2SO4 50 mL | ||
| C、该硫酸与等体积水混合质量分数变为49% | ||
D、取该硫酸100 mL,则浓度变为原来的
|
科学家已发现一种新型氢分子,其化学式为H3,在相同条件下,等质量的H3和H2相同的是( )
| A、摩尔质量 | B、分子数 |
| C、原子数 | D、物质的量 |
设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、lmol FeI2与足量氯气反应时转移的电子数为2NA | ||
B、室温下,14.0g分子通式为CnH2n烯烃中含有的碳碳双键数目为
| ||
| C、标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | ||
| D、氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |
V L浓度为0.5mol?L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )
| A、通入标准状况下的HCl气体11.2V L |
| B、加入10 mol?L-1的盐酸0.1V L,再稀释至1.5V L |
| C、将溶液加热浓缩到0.5V L |
| D、加入V L 1.5 mol?L-1的盐酸混合均匀 |
下列叙述正确的是( )
| A、直径在1~100 nm之间的粒子称为胶体 |
| B、胶体属于电解质溶液 |
| C、胶体粒子很小,可以透过半透膜 |
| D、利用丁达尔效应可以区别溶液与胶体 |
