题目内容
如图是某学校实验室买回的硫酸试剂标签的部分内容.判断下列说法正确的是( )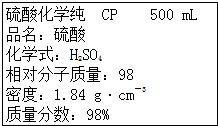

| A、该硫酸的浓度为9.2 mol?L-1 | ||
| B、配制200 mL 4.6 mol?L-1的稀H2SO4需该H2SO4 50 mL | ||
| C、该硫酸与等体积水混合质量分数变为49% | ||
D、取该硫酸100 mL,则浓度变为原来的
|
考点:物质的量浓度的相关计算
专题:计算题
分析:A.根据c=
计算浓硫酸的物质的量浓度;
B.根据稀释定律计算需要浓硫酸的体积;
C.硫酸的密度大于水,等体积硫酸、水混合后溶液的质量小于原硫酸的质量2倍;
D.溶液是均匀的,取出溶液的浓度与原溶液浓度相等.
| 1000ρω |
| M |
B.根据稀释定律计算需要浓硫酸的体积;
C.硫酸的密度大于水,等体积硫酸、水混合后溶液的质量小于原硫酸的质量2倍;
D.溶液是均匀的,取出溶液的浓度与原溶液浓度相等.
解答:
解:A.根据c=
可知,该浓硫酸的物质的量浓度为
mol/L=18.4mol/L,故A错误;
B.根据稀释定律,需要浓硫酸的体积为
=50mL,故B正确;
C.硫酸的密度大于水,等体积硫酸、水混合后溶液的质量小于原硫酸的质量2倍,故混合后的质量分数大于49%,故C错误;
D.溶液是均匀的,取出溶液的浓度与原溶液浓度相等为18.4mol/L,溶液中溶质的物质的量变为原溶液中的
,故D错误,
故选B.
| 1000ρω |
| M |
| 1000×1.84×98% |
| 98 |
B.根据稀释定律,需要浓硫酸的体积为
| 200mL×4.6mol/L |
| 18.4mol/L |
C.硫酸的密度大于水,等体积硫酸、水混合后溶液的质量小于原硫酸的质量2倍,故混合后的质量分数大于49%,故C错误;
D.溶液是均匀的,取出溶液的浓度与原溶液浓度相等为18.4mol/L,溶液中溶质的物质的量变为原溶液中的
| 1 |
| 5 |
故选B.
点评:本题考查溶液浓度计算,涉及物质的量浓度、质量分数等,难度不大,注意理解掌握物质的量浓度与质量分数之间的关系.

练习册系列答案
相关题目
下列化合物中,不能通过两种单质间化合直接制取的是( )
(1)Na2O (2)Na2O2 (3)CO (4)CO2 (5)FeCl2 (6)FeCl3 (7)CuS (8)Cu2S (9)NO (10)NO2 (11)SO2 (12)SO3 (13)AlCl3(14)Na2S.
(1)Na2O (2)Na2O2 (3)CO (4)CO2 (5)FeCl2 (6)FeCl3 (7)CuS (8)Cu2S (9)NO (10)NO2 (11)SO2 (12)SO3 (13)AlCl3(14)Na2S.
| A、(2)(4)(7)(12) |
| B、(3)(6)(8)(11) |
| C、(1)(5)(9)(14) |
| D、(5)(7)(10)(12) |
今有下列三个氧化还原反应:①2FeCl3+2KI═2FeCl2+2KCl+I2 ②2FeCl2+Cl2═2FeCl3③2KMnO4+16HCl(浓)═2KCl+2MnCl2+8H2O+5Cl2↑若某FeCl2溶液中有I-共存,要氧化除去I-而又不减少Fe2+和Cl-,可加入的试剂是( )
| A、Cl2 |
| B、KMnO4 |
| C、FeCl3 |
| D、HCl |
常温下,相同物质的量浓度的下列溶液,导电能力最强的是( )
| A、盐酸 | B、氨水 | C、醋酸 | D、碳酸钠 |
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A、5.6g铁粉在0.1mol氯气中充分燃烧,转移电了数为0.3NA |
| B、7.8gNa2S和 Na2O2的固体混合物中含有的阴离子数大于0.1NA |
| C、50mL l8.4mol?L浓浓硫酸与足量铜加热反应,生成SO2分子的数日为0.46NA |
| D、常温常压下,46gNO2和N2O4的混合物中含有2NA个氧原子 |
下列关于“摩尔”的说法正确的是( )
| A、摩尔是国际科学界建议采用的一种物理量 |
| B、摩尔是表示物质的量 |
| C、一摩尔物质都含有阿伏伽德罗常数个分子 |
| D、摩尔是物质的量的单位 |