题目内容
已知:2KMnO4=K2MnO4+MnO2+O2↑,将0.08mol KMnO4固体(质量为12.64g)加热一段时间后,收集到a molO2;向反应后残留的固体中加入足量的浓盐酸,又收集到b molCl2,此时Mn元素全部以Mn2+的形式存在于溶液中.
(1)配平下列化学方程式并用单线桥法标出电子转移方向和数目:KMnO4+HCl-KCl+MnCl2+Cl2↑+H2O
(2)上式反应中的还原剂是 ,反应中若产生0.2mol的气体则有 mol的电子转移.
(3)a+b的最大值为 ,a+b最小值为 .
(4)当 a+b=0.18时,残留固体的质量为 .
(1)配平下列化学方程式并用单线桥法标出电子转移方向和数目:KMnO4+HCl-KCl+MnCl2+Cl2↑+H2O
(2)上式反应中的还原剂是
(3)a+b的最大值为
(4)当 a+b=0.18时,残留固体的质量为
考点:氧化还原反应方程式的配平,氧化还原反应的电子转移数目计算
专题:氧化还原反应专题
分析:(1)Mn元素的化合价降低5,Cl元素的化合价升高1,由电子守恒和原子守恒配平,转移电子数=2×(7-2)=10×[0-(-1)]=10;
(2)在氧化还原反应中得电子价态降低的物质为还原剂,产生5个Cl2分子时,转移10个电子,反应中若产生0.2mol的气体则有0.4mol的电子转移;
(3)在氧化还原反应中得失电子数相等,所以反应过程中锰元素得到的电子数等于O元素、Cl元素失去的电子数,结合极限法计算;
(4)KMnO4固体(质量为12.64g)加热一段时间,发生反应:2KMnO4
K2MnO4+MnO2+O2↑,得到的固体是锰酸钾和二氧化锰的混合物,质量为12.64g的高锰酸钾分解得到锰酸钾和二氧化锰的质量和为:7.88g+3.52g=12.0g,即加热后残留固体的质量为12.0g.
(2)在氧化还原反应中得电子价态降低的物质为还原剂,产生5个Cl2分子时,转移10个电子,反应中若产生0.2mol的气体则有0.4mol的电子转移;
(3)在氧化还原反应中得失电子数相等,所以反应过程中锰元素得到的电子数等于O元素、Cl元素失去的电子数,结合极限法计算;
(4)KMnO4固体(质量为12.64g)加热一段时间,发生反应:2KMnO4
| ||
解答:
解:(1)Mn元素的化合价降低5,Cl元素的化合价升高1,由电子守恒和原子守恒可知,反应为2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,转移电子数=2×(7-2)=10×[0-(-1)]=10,单线桥表示为 ,
,
故答案为: ;
;
(2)在氧化还原反应中得电子价态降低的物质为氧化剂,反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中,HCl失电子价态升高为0价的氯气,所以HCl为还原剂;产生5个Cl2分子时,转移10个电子,反应中若产生0.2mol的气体则有0.4mol的电子转移,
故答案为:HCl;0.4;
(3)反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中,锰元素得到的电子数等于O元素、Cl元素失去的电子数,
所以0.08mol×(7-2)=2a×(2-0)mol+2b(1-0)mol,
则2a+b=0.2,a+b=0.2-a,
当高锰酸钾不分解生成氧气时,a=0,当高锰酸钾完全分解生成氧气时,生成氧气的物质的量为0.04mol,所以x的取值范围为:0≤a≤0.04,
所以0.16≤a+b≤0.2,即最大值为0.2,最小值为0.16;
故答案为:0.2;0.16;
(4)KMnO4固体(质量为12.64g)加热一段时间,发生反应:2KMnO4
K2MnO4+MnO2+O2↑,得到的固体是锰酸钾和二氧化锰的混合物,质量为12.64g的高锰酸钾分解得到锰酸钾和二氧化锰的质量和为:7.88g+3.52g=12.0g,即加热后残留固体的质量为12.0g.
故答案为:12.0g.
 ,
,故答案为:
 ;
;(2)在氧化还原反应中得电子价态降低的物质为氧化剂,反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中,HCl失电子价态升高为0价的氯气,所以HCl为还原剂;产生5个Cl2分子时,转移10个电子,反应中若产生0.2mol的气体则有0.4mol的电子转移,
故答案为:HCl;0.4;
(3)反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中,锰元素得到的电子数等于O元素、Cl元素失去的电子数,
所以0.08mol×(7-2)=2a×(2-0)mol+2b(1-0)mol,
则2a+b=0.2,a+b=0.2-a,
当高锰酸钾不分解生成氧气时,a=0,当高锰酸钾完全分解生成氧气时,生成氧气的物质的量为0.04mol,所以x的取值范围为:0≤a≤0.04,
所以0.16≤a+b≤0.2,即最大值为0.2,最小值为0.16;
故答案为:0.2;0.16;
(4)KMnO4固体(质量为12.64g)加热一段时间,发生反应:2KMnO4
| ||
故答案为:12.0g.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念、计算的考查,注意从化合价角度和习题信息角度分析,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列对有关实验事实的解释正确的是( )
| A、向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中含有Fe2+ |
| B、浓硫酸和浓盐酸长期暴露在空气中浓度均降低,原理不相同 |
| C、向某溶液中加入氯化钡溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液一定含有SO42- |
| D、常温下,浓硫酸可以用铁质容器储运,说明铁与冷的浓硫酸不反应 |
常温下,下列有关判断正确的是( )
| A、NaOH溶液与CH3COOH溶液混合至中性后:c(CH3COO-)=c(Na+)=c(H+)=c(OH-) |
| B、pH=3的CH3COOH溶液与pH=11的KOH溶液等体积混合后:c(K+)>c(CH3COO-)>c(OH-)>c(H+) |
| C、pH=2的HNO3溶液与pH=12的NH3?H2O溶液等体积混合后:c(NH4+)>c(H+)>c(OH-)>c(NO3-) |
| D、pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液,c(NH4+)大小顺序:①=②>③ |
某烃A与Br2发生加成反应生成二溴代物B.B用热的NaOH醇溶液处理得有机物C,经测定C的分子中含有两个双键,其分子式为C5H6.将C在催化条件下加氢可得到分子式为C5H10的有机物D,D的一氯代物只有1种结构.则烃A的结构简式为( )
| A、CH3CH2CH2CH═CH2 |
| B、CH2═CH-CH2-CH═CH2 |
C、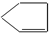 |
D、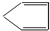 |
 某溶液中可能含有H+,Na+,Ba2+,Mg2+,Fe3+,Al3+,SO42-,CO32-等离子,当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列判断正确的是( )
某溶液中可能含有H+,Na+,Ba2+,Mg2+,Fe3+,Al3+,SO42-,CO32-等离子,当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列判断正确的是( )| A、原溶液中一定含有H+、Fe3+、Al3+,可能含Ba2+ |
| B、原溶液中含Fe3+和Al3+,物质的量之比为l:l |
| C、原溶液中可能含有CO32- |
| D、反应最后形成的溶液中含有的溶质只有NaAlO2 |
下列关于钠及其化合物的叙述中,正确的是( )
| A、一小块钠长期露置在空气中,最终变成NaOH固体 |
| B、氯化钠是一种性质稳定的化合物,可用作调味品,灼烧时火焰呈无色 |
| C、过氧化钠有很强的还原性,可作为潜水艇中的供氧剂 |
| D、向苯和水的混合体系中加入钠,钠块会在分界面上下不停跳动 |
Al(OH)3是一种常用的阻燃剂,添加在可燃物中的Al(OH)3受热分解的化学反应如下:2Al(OH)3
Al2O3+H2O.从而降低可燃物温度达到着火点以下,达到阻燃的目的.该反应属于( )
| ||
| A、氧化还原反应 | B、分解反应 |
| C、离子反应 | D、吸热反应 |