题目内容
研究燃料的燃烧和对污染气体产物的无害化处理,对于防止大气污染有重要意义.
(1)将煤转化为清洁气体燃料.已知:
H2 (g)+1/2O2(g)=H2O(g)△H=-242.0kJ/mol
C(s)+1/2O2(g)=CO(g)△H=-110.0kJ/mol
①写出焦炭与水蒸气反应制H2和CO的热化学方程式 .
②已知在101kPa时,CO、H2和CH4的燃烧热分别为283kJ/mol、286kJ/mol和892kJ/mol.则反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H= kJ/mol.
(2)已知一定温度和压强下,由H2和CO反应合成优质燃料甲醇:
CO(g)+2H2(g)?CH3OH(g)△H=-91kJ/mo1
①在相同条件下要想得到182kJ热量,加入各物质的物质的量可能是 .
A.2mo1CO和4mol H2
B.2mo1CO、4mol H2和1mol CH3OH(g)
C.4mo1CO和4mol H2
D.4mo1CO和6mol H2
②将1mol CO和2mol H2充入一密闭容器中,保持恒温恒压时进行反应,达到平衡时,测得CO的转化率为20%.若在相同条件下,起始时在该容器中充入1mol CH3OH(g),反应达到平衡时的热量变化是 (填“吸收”或“放出”) kJ热量.
(1)将煤转化为清洁气体燃料.已知:
H2 (g)+1/2O2(g)=H2O(g)△H=-242.0kJ/mol
C(s)+1/2O2(g)=CO(g)△H=-110.0kJ/mol
①写出焦炭与水蒸气反应制H2和CO的热化学方程式
②已知在101kPa时,CO、H2和CH4的燃烧热分别为283kJ/mol、286kJ/mol和892kJ/mol.则反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H=
(2)已知一定温度和压强下,由H2和CO反应合成优质燃料甲醇:
CO(g)+2H2(g)?CH3OH(g)△H=-91kJ/mo1
①在相同条件下要想得到182kJ热量,加入各物质的物质的量可能是
A.2mo1CO和4mol H2
B.2mo1CO、4mol H2和1mol CH3OH(g)
C.4mo1CO和4mol H2
D.4mo1CO和6mol H2
②将1mol CO和2mol H2充入一密闭容器中,保持恒温恒压时进行反应,达到平衡时,测得CO的转化率为20%.若在相同条件下,起始时在该容器中充入1mol CH3OH(g),反应达到平衡时的热量变化是
考点:用盖斯定律进行有关反应热的计算,有关反应热的计算
专题:化学反应中的能量变化
分析:(1)①根据已知反应方程式,利用盖斯定律解答;
②根据CO、H2和CH4的燃烧热写出化学方程式,再据盖斯定律解答;
(2)①由反应方程式可知生成1mol的CH3OH时放热91 kJ,想得到182kJ热量,则需生成2molCH3OH;由于反应是可逆反应,不可能完全进行到底,所以要得到2molCH3OH,CO与H2物质的量必须要多于2mol和4mol;
②已知反应:CO(g)+2H2(g)?CH3OH(g)△H=-91kJ/mo1,则有CH3OH(g)?CO(g)+2H2(g);△H=+91KJ?mol-1,保持恒温恒压,将1mol CO和2mol H2充入一密闭容器中与起始时在该容器中充入1mol CH3OH(g),为等效平衡状态,平衡时两种不同的途径平衡状态相同,各物质的含量、物质的量等都相同,以此计算.
②根据CO、H2和CH4的燃烧热写出化学方程式,再据盖斯定律解答;
(2)①由反应方程式可知生成1mol的CH3OH时放热91 kJ,想得到182kJ热量,则需生成2molCH3OH;由于反应是可逆反应,不可能完全进行到底,所以要得到2molCH3OH,CO与H2物质的量必须要多于2mol和4mol;
②已知反应:CO(g)+2H2(g)?CH3OH(g)△H=-91kJ/mo1,则有CH3OH(g)?CO(g)+2H2(g);△H=+91KJ?mol-1,保持恒温恒压,将1mol CO和2mol H2充入一密闭容器中与起始时在该容器中充入1mol CH3OH(g),为等效平衡状态,平衡时两种不同的途径平衡状态相同,各物质的含量、物质的量等都相同,以此计算.
解答:
解:(1)①已知:
①H2 (g)+1/2O2(g)=H2O(g)△H=-242.0kJ/mol
②C(s)+1/2O2(g)=CO(g)△H=-110.0kJ/mol
据盖斯定律,②-①得:C(s)+H2O(g)=CO(g)+H2 (g)△H=+132.0kJ/mol,故答案为:C(s)+H2O(g)=CO(g)+H2 (g)△H=+132.0kJ/mol;
②CO、H2和CH4的燃烧热分别为283kJ/mol、286kJ/mol和892kJ/mol,其热化学方程式为:
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ?mol-1
②CH4(g)+2O2(g)=CO2(g)+2 H2O(l)△H=-892kJ?mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ?mol-1
据盖斯定律,②-①-③×3得:CH4(g)+H2O(l)?CO(g)+3H2(g)△H=+205KJ/mol,故答案为:+205KJ/mol;
(2)①由反应方程式可知生成1mol的CH3OH时放热91 kJ,想得到182kJ热量,则需生成2molCH3OH;由于反应是可逆反应,不可能完全进行到底,所以要得到2molCH3OH,CO与H2物质的量必须要多于2mol和4mol,
故答案为:D;
②CO(g)+2H2(g)?CH3OH(g)△H=-91kJ/mo1
起始量 1 2 0
转化量0.2 0.4 0.2
平衡量0.8 1.6 0.2
CH3OH(g)?CO(g)+2H2(g);△H=+91KJ?mol-1,
起始量 1 0 0
转化量 0.8 0.8 1.6
转化量 0.2 0.8 1.6
生成1molCH3OH放热91KJ,分解1molCH3OH吸热91KJ,分解0.8mol甲醇,吸热72.8KJ,故答案为:吸收;72.8.
①H2 (g)+1/2O2(g)=H2O(g)△H=-242.0kJ/mol
②C(s)+1/2O2(g)=CO(g)△H=-110.0kJ/mol
据盖斯定律,②-①得:C(s)+H2O(g)=CO(g)+H2 (g)△H=+132.0kJ/mol,故答案为:C(s)+H2O(g)=CO(g)+H2 (g)△H=+132.0kJ/mol;
②CO、H2和CH4的燃烧热分别为283kJ/mol、286kJ/mol和892kJ/mol,其热化学方程式为:
①CO(g)+
| 1 |
| 2 |
②CH4(g)+2O2(g)=CO2(g)+2 H2O(l)△H=-892kJ?mol-1
③H2(g)+
| 1 |
| 2 |
据盖斯定律,②-①-③×3得:CH4(g)+H2O(l)?CO(g)+3H2(g)△H=+205KJ/mol,故答案为:+205KJ/mol;
(2)①由反应方程式可知生成1mol的CH3OH时放热91 kJ,想得到182kJ热量,则需生成2molCH3OH;由于反应是可逆反应,不可能完全进行到底,所以要得到2molCH3OH,CO与H2物质的量必须要多于2mol和4mol,
故答案为:D;
②CO(g)+2H2(g)?CH3OH(g)△H=-91kJ/mo1
起始量 1 2 0
转化量0.2 0.4 0.2
平衡量0.8 1.6 0.2
CH3OH(g)?CO(g)+2H2(g);△H=+91KJ?mol-1,
起始量 1 0 0
转化量 0.8 0.8 1.6
转化量 0.2 0.8 1.6
生成1molCH3OH放热91KJ,分解1molCH3OH吸热91KJ,分解0.8mol甲醇,吸热72.8KJ,故答案为:吸收;72.8.
点评:本题考查了盖斯定律的应用、燃烧热、逆反应的反应热,题目难度中等.

练习册系列答案
相关题目
环境监测测定水中溶解O2的方法是:量取a mL水样,迅速加入MnSO4溶液及含有NaOH的KI溶液,立即塞好塞子,振荡混合摇匀.开塞,迅速加入适量的硫酸,此时有I2生成.用Na2S2O3溶液(b mol/L)和I2反应消耗V mL(以淀粉为指示剂),有关反应的离子方程式为:2Mn2++O2+4OH-=2MnO(OH)2(快),MnO(OH)2+2I-+2H+=Mn2++I2+3H2O,I2+S2O32-=2I-+S4O62-,则水中溶解氧量(单位是mg/L)为( )
| A、8000ab/V |
| B、8000Vb/a |
| C、16000Vb/a |
| D、16000ab/V |
可逆反应:3A(g)═3B(?)+C(?)(正反应吸热),随着温度的升高,气体平均相对分子质量变小,则下列判断正确的是( )
| A、B和C都是固体 |
| B、B和C一定都是气体 |
| C、B和C可能都是气体 |
| D、无法判断 |
下列化合物在核磁共振氢谱中能出现两组峰,且其峰面积之比为3:1的是( )
| A、对二甲苯 | B、乙酸乙酯 |
| C、乙醛 | D、苯 |
下列金属中,遇到强酸或强碱都能放出氢气的是( )
| A、Cu | B、Mg | C、Fe | D、Al |
下列物质中属于强电解质的是( )
| A、NH3 |
| B、乙醇 |
| C、Cu |
| D、NaCl |
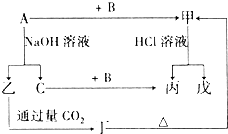 金属单质A和非金属单质B、C及甲、乙、丙、丁、戊五种化合物有如图所示的转化关系,甲是工业上冶炼A的主要原料,丙是一种无色无味的液体.请回答:
金属单质A和非金属单质B、C及甲、乙、丙、丁、戊五种化合物有如图所示的转化关系,甲是工业上冶炼A的主要原料,丙是一种无色无味的液体.请回答: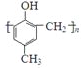 )的合成路线如下:
)的合成路线如下:
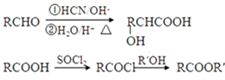 ,F分子式为C7H8O,
,F分子式为C7H8O,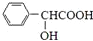 )有多种同分异构体,其中满足下述条件的同分异构体有
)有多种同分异构体,其中满足下述条件的同分异构体有