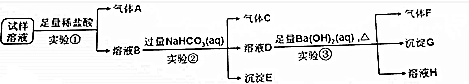
题目内容
20.关于如图中原电池的盐桥(由饱和KCl溶液和琼脂制成)说法正确的是( )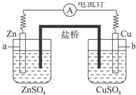
| A. | 有无盐桥不影响该原电池的工作 | |
| B. | 电池工作时,盐桥中K+会向Zn电极一侧移动 | |
| C. | 电池工作时,盐桥中Cl-会向Zn电极一侧移动 | |
| D. | 电池工作时,盐桥中的电子由Cu电极向Zn电极移动 |
分析 该原电池中,较活泼的金属Zn作负极,负极上Zn失电子发生氧化反应;较不活泼的金属Cu作正极,正极上Cu离子得电子发生还原反应;该原电池中盐桥的作用是平衡两个半电池中的阴阳离子,使该装置构成闭合回路,溶液中阳离子向正极移动,阴离子向负极移动,据此分析.
解答 解:A.没有盐桥,不能形成闭合回路,则不能形成原电池,故A错误;
B.电池工作时,盐桥中K+会向正极移动,即向Cu电极一侧移动,故B错误;
C.电池工作时,盐桥中Cl-会向负极移动,即向Zn电极一侧移动,故C正确;
D.电子只能在导线中移动,不能在溶液中移动,所以电子不能通过盐桥,故D错误.
故选C.
点评 本题考查了原电池原理,侧重于学生的分析能力的考查,明确原电池中正负极上发生的反应是解本题关键,注意电子不经过电解质溶液,为易错点,难度不大

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
11.下列关于乙酸的说法不正确的是( )
| A. | 可以除去热水瓶内胆水垢 | B. | 具有挥发性 | ||
| C. | 能与乙醇反应生成有香味的酯 | D. | 能发生加聚反应 |
8.将盛有amolNO2和bmolNO混合气体的试管倒立于水槽中,再通人bmolO2充分反应后试管里剩余气体的成分及物质的量决定于a与b的关系,请填写表格:
| a与b的关系 | 剩余气体的成分 | 剩余气体物质的量 |
| 若a=b | ||
| 若a>b | ||
| 若a<b |
9.金属钛对体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称.下列有关${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti的说法正确的是( )
| A. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti 原子中均含22个中子 | |
| B. | 分别由${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti 组成的金属钛单质互称同分异构体 | |
| C. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti 在周期表中位置相同,都在第四周期 | |
| D. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti为同一核素 |
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ,•mol-1.(注:燃烧热:1mol燃料完全燃烧所放出的能量即为该燃料的燃烧热.)请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ,•mol-1.(注:燃烧热:1mol燃料完全燃烧所放出的能量即为该燃料的燃烧热.)请回答下列问题: