题目内容
8.将盛有amolNO2和bmolNO混合气体的试管倒立于水槽中,再通人bmolO2充分反应后试管里剩余气体的成分及物质的量决定于a与b的关系,请填写表格:| a与b的关系 | 剩余气体的成分 | 剩余气体物质的量 |
| 若a=b | ||
| 若a>b | ||
| 若a<b |
分析 根据反应4NO2+O2+2H2O=4HNO3、3NO2+H2O=2HNO3+NO可知,当二氧化氮、NO和氧气都恰好完全反应方程式为:4NO2+4NO+4O2+2H2O═8HNO3,即a=b,此时无气体剩余;
若a>b,二氧化氮过量,NO完全发生反应4NO2+4NO+4O2+2H2O═8HNO3,剩余的二氧化氮发生反应3NO2+H2O=2HNO3+NO,bmolNO完全反应消耗二氧化氮为bmol,则剩余的二氧化氮为(a-b)mol,再根据反应3NO2+H2O=2HNO3+NO计算出剩余的NO气体的物质的量;
若a<b,说明O2过量,二氧化氮发生反应4NO2+4NO+4O2+2H2O═8HNO3,剩余的NO发生反应4NO+3O2+2H2O═4HNO3,其中发生反应4NO2+4NO+4O2+2H2O═8HNO3消耗的NO、O2为amol,则发生反应4NO+3O2+2H2O═4HNO3消耗的O2为(b-a)mol×$\frac{3}{4}$=$\frac{3}{4}$(b-a)mol,据此计算出最终剩余的氧气的物质的量.
解答 解:若a=b时,发生反应为:4NO2+4NO+4O2+2H2O═8HNO3,则反应后无气体剩余;
若a>b,二氧化氮过量,NO完全发生反应:4NO2+4NO+4O2+2H2O═8HNO3,剩余的二氧化氮发生反应:3NO2+H2O=2HNO3+NO,bmolNO完全反应消耗二氧化氮为bmol,则剩余的二氧化氮为(a-b)mol,根据反应3NO2+H2O=2HNO3+NO可知,剩余的NO气体为:$\frac{1}{3}$(a-b)mol;
若a<b,O2过量,二氧化氮发生反应:4NO2+4NO+4O2+2H2O═8HNO3,剩余的NO发生反应:4NO+3O2+2H2O═4HNO3,其中发生反应4NO2+4NO+4O2+2H2O═8HNO3消耗的NO、O2为amol,则发生反应4NO+3O2+2H2O═4HNO3消耗的O2为(b-a)mol×$\frac{3}{4}$=$\frac{3}{4}$(b-a)mol,则最终剩余的氧气为:bmol-amol-$\frac{3}{4}$(b-a)mol=$\frac{1}{4}$(b-a)mol,
故答案为:
| a与b的关系 | 剩余气体的成分 | 剩余气体物质的量 |
| 若a=b | 无 | 0 |
| 若a>b | NO | $\frac{1}{3}$(a-b)mol |
| 若a<b | O2 | $\frac{1}{4}$(b-a)mol |
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握讨论法在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

| A. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也无同分异构体 | |
| B. | 淀粉、油脂、蛋白质、纤维素都能在人体内水解,也能在体内氧化提供能量 | |
| C. | 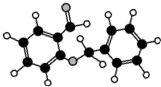 如图所示的有机物分子式为C14H12O2,能发生银镜反应 | |
| D. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |
| A. | 1 mol氧为32 g | |
| B. | 标准状况下,1 mol H2和O2的混合气体的体积约为22.4 L | |
| C. | CO2的摩尔质量为44 | |
| D. | 2 mol•L-1的BaCl2溶液中含Cl-的个数为2.408×1024 |
| A. | 物质在反应中失去电子,该物质是氧化剂 | |
| B. | 置换反应一定属于氧化还原反应 | |
| C. | 氧化还原反应的本质是元素化合价的升降 | |
| D. | 发生反应时,电子不可以在同种元素间转移 |
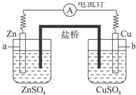
| A. | 有无盐桥不影响该原电池的工作 | |
| B. | 电池工作时,盐桥中K+会向Zn电极一侧移动 | |
| C. | 电池工作时,盐桥中Cl-会向Zn电极一侧移动 | |
| D. | 电池工作时,盐桥中的电子由Cu电极向Zn电极移动 |
