题目内容
物质的量浓度相同的下列溶液①(NH4)2CO3 ②(NH4)2SO4③NH4HCO3 ④NH4HSO4⑤NH4Cl ⑥NH3?H2O;按c(NH4+)由小到大的排列顺序正确的是( )
| A、③⑤④⑥①③ |
| B、⑥⑤③④①② |
| C、⑥③⑤④①② |
| D、⑥③⑤④②① |
考点:盐类水解的应用
专题:盐类的水解专题
分析:物质的量相等的这几种溶液中,NH3?H2O溶液中c(NH4+)小于铵盐的c(NH4+),铵根离子水解程度较小,所以要比较铵根离子浓度大小,先比较盐中铵根离子的系数,系数越大,溶液中铵根离子浓度越大,相同系数的铵盐溶液,再根据溶液中其它离子是促进铵根离子水解还是抑制铵根离子水解判断即可.
解答:
解:NH3?H2O是弱电解质,电离程度很小,故溶液中c(NH4+)小于所有铵盐的c(NH4+),即一水合氨溶液中铵根离子浓度最小;③④⑤中铵根离子系数都是1,碳酸氢根离子促进铵根离子水解,氢离子抑制铵根离子水解;①②中铵根离子系数都是2,其溶液中铵根离子浓度大于其余溶液中铵根离子浓度,碳酸根离子促进铵根离子水解,则溶液c(NH4+)由小到大的排列顺序是 ⑥<③<⑤<④<①<②,故选C.
点评:本题考查了铵根离子浓度的比较,先根据强弱电解质进行分离,再根据铵根离子系数进行分类,最后根据其它离子对铵根离子的影响来分类即可,难度中等.

练习册系列答案
相关题目
A L硫酸铝溶液中,含有B mol铝离子,则此溶液的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列对有关物质性质的分析正确的是( )
| A、IBr可与水反应生成HIO和HBr |
| B、在高温下用氢气还原MgCl2可制取金属镁 |
| C、Na久置于空气中,最终生成NaHCO3 |
| D、打开盛浓盐酸的试剂瓶可看到白色的雾,说明HCl不稳定 |
 一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器中,发生如下反应:
一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器中,发生如下反应:A(g)+B(g)?x C(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C 的浓度随时间变化如图所示.下列说法正确是( )
| A、反应方程式中的x=1 |
| B、t1~t3间该反应的平衡常数均为4 |
| C、t3时刻改变的条件是移去少量物质D |
| D、t3时刻改变的条件是使用催化剂 |
配制500mL 1mol/LHCl溶液时,不需要的仪器是( )
| A、容量瓶(500mL) |
| B、分液漏斗 |
| C、烧杯 |
| D、胶头滴管 |
按如图所示装置进行下列不同的操作,其中不正确的是( )
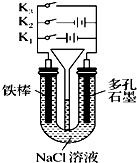

| A、只接通K1,一段时间后,U形管中出现白色沉淀 |
| B、只接通K2,U形管左、右两端液面均下降 |
| C、若U形管左、右两端上方充入一些空气,铁腐蚀的速度由大到小的顺序是:只接通K1>只接通K3>都断开>只接通K2 |
| D、若将氯化钠溶液改为氢氧化钠溶液,铁棒改为多孔石墨,先只接通K2,一段时间后,漏斗内液面上升,然后再只接通K3,则接通K3后装置中无电流通过 |
下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A、0.1 mol?L-1 NaHB溶液 pH=4,则溶液中:c(HB-)>c(B2-)>c(H2B) |
| B、0.1 mol?L-1 (NH4)2Fe(SO4)2溶液中:c(NH4+)+c(Fe2+)=0.3 mol?L-1 |
| C、NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| D、Na2CO3溶液中:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Na+) |
下列化合物分别跟溴和铁粉的混合物反应,苯环上的氢被溴原子取代,所得一溴代物有2种同分异构体的是( )
| A、乙苯 | B、邻-二甲苯 |
| C、间-二甲苯 | D、对-二甲苯 |