题目内容
12.化学与生活密切相关,下列说法不正确的是( )| A. | 改燃煤为燃气,可以减少废气中SO2等有害物质的排放量天气的一种措施 | |
| B. | 84 消毒液的有效成分是 NaClO | |
| C. | 含有食品添加剂的食物对人体健康不一定有益 | |
| D. | 金属防护中:牺牲阳极的阴极保护法利用的是电解原理,外加电流的阴极保护法利用的 是原电池原理 |
分析 A.改燃煤为燃气,可减少二氧化硫的排放量,可减少PM2.5的排放;
B.氯气与氢氧化钠反应可得84消毒液;
C.食品添加剂中某些物质有毒,对人体有害;
D.利用原电池原理的牺牲阳极的阴极保护法,外加电流的阴极保护法利用的是电解原理.
解答 解:A.改燃煤为燃气,可减少废气中SO2等有害物质的量,减少环境污染物的排放,可有效减少雾霾发生,故A正确;
B.氯气与氢氧化钠反应可得84消毒液,有效成分为NaClO,故B正确;
C.食品添加剂中某些物质有毒,对人体有害,所以含有食品添加剂的食物对人体健康不一定有益,故C正确;
D.原电池的正极及电解池的阴极中的金属被保护,所以利用电化学原理保护金属主要有两种方法,分别是牺牲阳极的阴极保护法和外加电流的阴极保护法,故D错误;
故选:D.
点评 本题考查环境污染及保护以及生活中的材料等知识,熟悉相关物质的性质是解题关键,注意金属腐蚀的原理及防护措施,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.用NA代表阿伏加德罗常数,下列说法中不正确的是( )
| A. | 3.2g氧气所含氧分子数为0.2NA | |
| B. | 1L0.1mol/L NaCl 溶液中所含的Na+为0.1NA | |
| C. | 0.012 kg 12C中含有碳原子数约为NA | |
| D. | 24g镁变成镁离子时失去的电子数为2N A |
20.下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤AlCl3 ⑥NaAlO2.
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤AlCl3 ⑥NaAlO2.
| A. | ③④⑤ | B. | ②③④ | C. | ①③④⑥ | D. | ①②③④ |
7.某校化学实验小组对电化学问题进行了如图所示实验探究.
探究一:探究弱酸性条件下铁发生电化学腐蚀类型的影响因素.将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图所示).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
(1)请完成以下实验设计表(表中不要留空格):
(2)编号①实验测得容器中的压强随时间的变化如图(2)所示.t2时,容器中压强明显小于起始压强,其原因是铁发生了吸氧 腐蚀,请在图(3)中用箭头标出发生该腐蚀时电子的流动方向;此时,炭粉表面发生的电极反应式是O2+2H2O+4e-═4OH-.
(3)该小组对图(2)中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:反应放热使锥形瓶内温度升高;
探究二:探究电解现象
利用图2装置做电解50mL 0.5mol•L-1CuCl2溶液的实验.
实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色(提示:Cl2氧化性大于IO3-);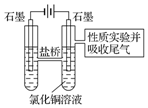
B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体.
(4))分析实验记录A中试纸颜色变化,用离子方程式解释:
①2I-+Cl2=I2+2Cl-;
②5Cl2+I2+6H2O=10Cl-+2IO3-+12H+.
(5)分析实验记录B中浅蓝色固体可能是Cu(OH)2(写化学式),试分析生成该物质的原因(用必要的文字和化学用语解释)电解较长时间后,铜离子浓度下降,氢离子开始放电,溶液的PH增大,铜离子转化为氢氧化铜沉淀.
探究一:探究弱酸性条件下铁发生电化学腐蚀类型的影响因素.将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图所示).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.

(1)请完成以下实验设计表(表中不要留空格):
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.5 | 90.0 |
| ② | ? | 0.5 | 2.5 | 36.0 |
| ③ | 碳粉质量的影响 | 0.2 | ? | 90.0 |
(3)该小组对图(2)中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:反应放热使锥形瓶内温度升高;
探究二:探究电解现象
利用图2装置做电解50mL 0.5mol•L-1CuCl2溶液的实验.
实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色(提示:Cl2氧化性大于IO3-);

B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体.
(4))分析实验记录A中试纸颜色变化,用离子方程式解释:
①2I-+Cl2=I2+2Cl-;
②5Cl2+I2+6H2O=10Cl-+2IO3-+12H+.
(5)分析实验记录B中浅蓝色固体可能是Cu(OH)2(写化学式),试分析生成该物质的原因(用必要的文字和化学用语解释)电解较长时间后,铜离子浓度下降,氢离子开始放电,溶液的PH增大,铜离子转化为氢氧化铜沉淀.
17.在体积固定的绝热密闭容器中发生如下反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),下列选项不能判断该反应已达到平衡状态是( )
| A. | v正(H2)=2v逆(CO) | |
| B. | 平衡常数K不再随时间而变化 | |
| C. | 混合气体的密度保持不变 | |
| D. | 混合气体的平均相对分子质量不随时间而变化 |
1.无机化合物可根据其组成和性质进行分类:
(1)Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,将化学式分别填在表②的后面;(只需填一种)
(2)写出⑦转化为⑧的化学方程式2SO2+O2$\frac{\underline{\;催化剂\;}}{△}$2SO3;
(3)写出Cu和①的浓溶液反应的化学方程式Cu+2H2SO4(浓)═Cu SO4 +SO2↑+2H2O;
(4)实验室制备⑨常用NH4Cl和Ca(OH)2 反应,检验该气体的方法是用湿润的红色石蕊试纸放于试管口,试纸变蓝.
(1)Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,将化学式分别填在表②的后面;(只需填一种)
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ②HNO3 | ③NaOH ④KOH | ⑤Na2SO4 ⑥K2SO4 | ⑦SO2 ⑧SO3 | ⑨NH3 |
(3)写出Cu和①的浓溶液反应的化学方程式Cu+2H2SO4(浓)═Cu SO4 +SO2↑+2H2O;
(4)实验室制备⑨常用NH4Cl和Ca(OH)2 反应,检验该气体的方法是用湿润的红色石蕊试纸放于试管口,试纸变蓝.