题目内容
3.用NA代表阿伏加德罗常数,下列说法中不正确的是( )| A. | 3.2g氧气所含氧分子数为0.2NA | |
| B. | 1L0.1mol/L NaCl 溶液中所含的Na+为0.1NA | |
| C. | 0.012 kg 12C中含有碳原子数约为NA | |
| D. | 24g镁变成镁离子时失去的电子数为2N A |
分析 A.根据n=$\frac{m}{M}$计算出氧气的物质的量,然后根据N=nNA计算出含有分子数;
B.根据n=cV计算出含有氯化钠的物质的量,然后根据N=nNA计算出含有钠离子数目;
C.0.012 kg 12C中含有阿伏伽德罗常数个碳原子;
D.Mg为+2价金属,1mol镁完全反应失去2mol电子.
解答 解:A.3.2g氧气的物质的量为:$\frac{3.2g}{32g/mol}$=0.1mol,所含氧分子数应该为0.1NA,故A错误;
B.1L0.1mol/L NaCl 溶液中含有0.1mol氯化钠,含有钠离子的物质的量为0.1mol,所含的Na+为0.1NA,故B正确;
C.0.012 kg 12C的物质的量为:$\frac{12g}{12g/mol}$=1mol,含有碳原子数为NA,故C正确;
D.24g镁的物质的量为:$\frac{24g}{24g/mol}$=1mol,1molMg变成镁离子时失去2mol电子,失去的电子数为2N A,故D正确;
故选A.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;试题有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
14.分子式为C9H6O3(只有苯环而不含其它的环)的有机物苯环上的一氯取代物只有一种的结构种类为( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
18.利用如图所示装置进行下列实验,试管②中一定观察不到的现象是( )
| 选项 | a | b | c | 试管②中现象 | 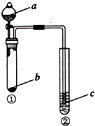 |
| A | NaOH溶液 | Al | 肥皂水 | 肥皂泡可点燃 | |
| B | 稀盐酸 | 碳酸钙 | NaAlO2溶液 | 生成白色絮状沉淀生成 | |
| C | 稀硫酸 | NaHCO3 | BaCl2溶液 | 溶液变浑浊 | |
| D | 水 | Na2O2 | 酸化的FeSO4溶液 | 溶液变黄 |
| A. | A | B. | B | C. | C | D. | D |
8.X(g)+3Y(g)?2Z(g)△H=-a kJ•mol-1,一定条件下,将1mol X和3mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4mol.下列说法正确的是( )
| A. | 10 min内,Y的平均反应速率为0.03 mol•L-1•s-1 | |
| B. | 10 min内,X和Y反应放出的热量为a kJ | |
| C. | 10 min内,消耗0.2 mol X,生成0.4 mol Z | |
| D. | 10 min内,前5minX的平均反应速率与后5minX的平均反应速率相同 |
15.在汽车尾气系统中安装催化转化器,可有效降低尾气中CO和NO等向大气的排放.在催化转化器中,CO和NO发生反应:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.该反应的氧化剂是( )
| A. | CO | B. | NO | C. | CO2 | D. | N2 |
12.化学与生活密切相关,下列说法不正确的是( )
| A. | 改燃煤为燃气,可以减少废气中SO2等有害物质的排放量天气的一种措施 | |
| B. | 84 消毒液的有效成分是 NaClO | |
| C. | 含有食品添加剂的食物对人体健康不一定有益 | |
| D. | 金属防护中:牺牲阳极的阴极保护法利用的是电解原理,外加电流的阴极保护法利用的 是原电池原理 |
13.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 0.1 molNa2O2与足量的CO2充分反应转移的电子数为0.2NA | |
| B. | 常温常压下,18g H2O 所含的中子数为8NA | |
| C. | 0.1 mol铁在0.1 mol Cl2中充分燃烧,有0.3NA个电子转移 | |
| D. | 将含0.l mol FeCl3的饱和溶液制成胶体后,生成的Fe(OH)3胶粒数目为0.1NA |
