题目内容
17.下列说法不正确的是( )| A. | 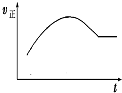 绝热恒容密闭容器中通入A和B,发生反应:2A (g)+B (g)?2C(g),如图为其正反应速率随时间变化的示意图,则该反应为放热反应 | |
| B. | 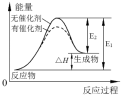 催化剂能降低反应的活化能,提高活化分子的百分含量,从而加快化学反应速率.如图显示的是催化反应与无催化反应过程中的能量关系 | |
| C. |  将BaO2放入密闭真空容器中,反应2BaO2(s)?2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的$\frac{1}{2}$,体系重新达到平衡,体系压强变化如图所示 | |
| D. | 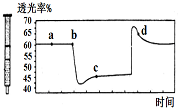 将一定量的NO2充入针筒中后封口,发生反应2NO2 (g)?N2O4(g),如图表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).则c点与a点相比,c(NO2)增大,c(N2O4)减小. |
分析 A.绝热恒容密闭容器中通入A和B,反应开始反应物浓度最大,反应速率逐渐增大,说明反应为放热反应,温度升高,反应速率增大,随着反应的进行,反应物浓度逐渐减小,则反应速率逐渐减小,以此解答;
B.催化剂降低反应的活化能改变反应历程,提高活化分子的百分含量,能加快反应速率;
C.保持温度不变,t0时刻将容器体积缩小为原来的$\frac{1}{2}$,若平衡不变,氧气的浓度应为原来的2倍,气体压强为原来的2倍,但压强增大平衡逆向进行,压强减小,最后达到新的平衡状态,由于平衡常数随温度变化,温度不变平衡常数不变,氧气浓度不变;
D.该反应是正反应气体体积减小的放热反应,压强增大平衡虽正向移动,但二氧化氮浓度增大,混合气体颜色变深,压强减小平衡逆向移动,但二氧化氮浓度减小,混合气体颜色变浅,据图分析,b点开始是压缩注射器的过程,气体颜色变深,透光率变小,c点后的拐点是拉伸注射器的过程,气体颜色变浅,透光率增大,据此分析.
解答 解:A、绝热恒容密闭容器中通入A和B,发生反应:2A (g)+B (g)?2C(g),反应开始反应物浓度最大,反应速率逐渐增大,说明反应为放热反应,随着反应的进行,反应物浓度逐渐减小,则反应速率逐渐减小,最后达到平衡状态,正反应速率不再变化,故A正确;
B.催化剂降低反应的活化能改变反应历程,提高活化分子的百分含量,能加快反应速率,图象分析可知是催化反应与无催化反应过程中的能量关系,故B正确;
C.将BaO2放入密闭真空容器中,反应2BaO2(s)?2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的$\frac{1}{2}$,不考虑平衡移动,氧气的浓度应为原来的2倍,气体压强为原来的2倍,但压强增大平衡逆向进行,所以压强减小,平衡常数不变,氧气浓度不变,所以最后达到平衡压强为仍为P,故C正确;
D.上述分析可知,c点是压缩注射器后的情况,二氧化氮和四氧化二氮的浓度都增大,故D错误;
故选D.
点评 本题考查了化学平衡影响因素分析,催化剂对化学反应的影响,通过图象和透光率考查了压强对平衡移动的影响,注意勒夏特列原理的应用,题目难度中等.

 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案| A. | 反应I2(g)+H2(g)?2H I(g) 达平衡后,压缩体积体系颜色变深 | |
| B. | H2O2中加入二氧化锰,生成氧气的速率加快 | |
| C. | 棕黄色的FeCl3溶液中加入铁粉颜色逐渐变为浅绿色 | |
| D. | 反应CO(g)+NO2(g)?CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 |
| A. | Na+、HCO3-、Cl-、SO42- | B. | Na+、Fe2+、Cl-、SO42- | ||
| C. | Na+、SO42-、Cl-、ClO- | D. | NH4+、Na+、NO3-、Cl- |
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B:KNO3;D:CuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3.
(3)写出实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═[Al(OH)4]-.
(4)C常用作净水剂,用离子方程式表示其净水原理:Al3++3H2O?Al(OH)3(胶体)+3H+.
| A. | 1.43g/L | B. | 1.90g/L | C. | 2.14g/L | D. | 2.38g/L |
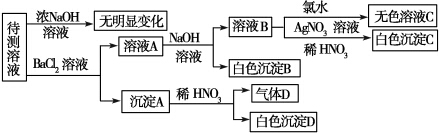
请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填).
| 肯定存在的离子 | 肯定没有的离子 | 沉淀D | ||
| 化学式或 离子符号 | ||||
(3)若Mn+为常见金属阳离子且原子序数不大于20,则要确定它具体是何种离子的方法是做焰色反应实验,若透过蓝色钴玻璃片观察到紫色火焰,说明是K+;若不透过蓝色钴玻璃片观察到黄色火焰,则说明是Na+.
| A. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.6mol H2SO4的稀硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ | |
| D. | 需要加热的反应说明它是吸热反应 |