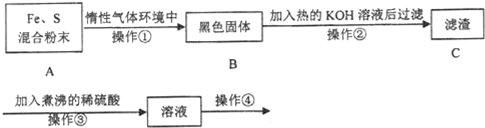
题目内容
1.已知反应4NH3+5O2=4NO+6H2O(g),下列表示的反应速率最大的是( )| A. | V(NH3)=0.6mol/(L•S) | B. | V(O2)=0.7mol/(L•S) | C. | V(NO)=0.5mol/(L•S) | D. | V(H2O)=0.8mol/(L•S) |
分析 化学反应速率之比等于化学计量数之比,则反应速率与化学计量数的比值越大,反应速率越快,以此来解答.
解答 解:反应速率与化学计量数的比值越大,反应速率越快,则
A.$\frac{0.6}{4}$=0.15;
B.$\frac{0.7}{5}$=0.14;
C.$\frac{0.5}{4}$=0.125;
D.$\frac{0.8}{6}$=0.133,
显然A中比值最大,反应速率最快,
故选A.
点评 本题考查反应速率的比较,把握反应速率与化学计量数的关系为解答的关键,侧重分析与应用能力的考查,注意比值法的应用,也可转化为同种物质的速率再比较,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.化石燃料是最重要的能源之一.下列关于化石燃料的说法错误的是( )
| A. | 石油的分馏产物主要成分是碳氢化合物 | |
| B. | 工业上可通过石油的裂解获得大量乙烯 | |
| C. | 重油经过裂化可以得到汽油 | |
| D. | 煤中含有苯、甲苯,可用分馏的方法将它们分离 |
6.现有部分短周期元素的性质或原子结构如下表
(1)元素T的阴离子的结构示意图 .
.
(2)元素Y在周期表中的位置是第二周期ⅤA族.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示).下列表述中能证明这一事实的是bce.
a.常温下Z的单质和T的单质状态不同 b.Z的氢化物比T的氢化物稳定
c.Z的最高价氧物所对应的水化物比T的最高价氧化物所对应的水化物的酸性强
d.Z的氢化物笔比T的氢化物溶解度大
e.Z的单质与H2化合比T的单质与H2化合更容易
(4)结合所学的知识,请设计一个与(3)中的事实不同的实验方案证明元素Z与元素T的非金属性的强弱将氯气通入到Na2S溶液中,若产生淡黄色沉淀,则证明非金属性Cl>S.
| 元素编号 | 元素性质或原子结构 |
| T | M层的电子数为K层电子数的3倍 |
| X | 其化合物的种类最多且其氢化物是一种清洁能源 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价+7价 |
 .
.(2)元素Y在周期表中的位置是第二周期ⅤA族.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示).下列表述中能证明这一事实的是bce.
a.常温下Z的单质和T的单质状态不同 b.Z的氢化物比T的氢化物稳定
c.Z的最高价氧物所对应的水化物比T的最高价氧化物所对应的水化物的酸性强
d.Z的氢化物笔比T的氢化物溶解度大
e.Z的单质与H2化合比T的单质与H2化合更容易
(4)结合所学的知识,请设计一个与(3)中的事实不同的实验方案证明元素Z与元素T的非金属性的强弱将氯气通入到Na2S溶液中,若产生淡黄色沉淀,则证明非金属性Cl>S.
11.关于碱金属单质的性质叙述错误的是( )
| A. | 钠在空气中燃烧的生成物是过氧化钠 | |
| B. | 与水反应时都能生成碱和氢气 | |
| C. | 熔沸点随原子序数增加而升高 | |
| D. | 碱金属单质还原性随原子电子层数的增加而增加 |
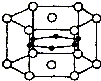 图为硼和镁两种元素组成的超导材料的晶体结构单元示意图,其中该化合物镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内.则该化合物的化学式可表示为MgB2.
图为硼和镁两种元素组成的超导材料的晶体结构单元示意图,其中该化合物镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内.则该化合物的化学式可表示为MgB2.