��Ŀ����
3����ͼ�����������dz����������Ʊ����������ռ�װ�ã�����Ҫ��ش��������⣺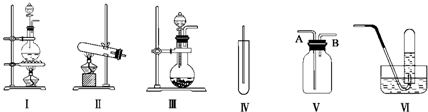
��1������MnO2��Ũ���ᷴӦ��ȡ������Ӧѡ�÷���װ�â��û�ѧ����ʽ��ʾ��ȡ�����ķ�Ӧԭ����MnO2+4HC1��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnC12+C12��+2H2O��
��2������KMnO4��Ũ���ᷴӦ��ȡ������Ӧѡ�÷���װ�â�����ɲ���ƽ�������ӷ���ʽ��2MnO${\;}_{4}^{-}$+10Cl-+16H+�T2Mn2++5Cl2��+8H2O��
��3����ѡ��MnO2��Ũ���ᷴӦ��ȡ������������־����ͣ�����ѡ���װ�������ӣ�װ����ʢ�ŵ���Һ����Ϊ����ʳ��ˮ��Ũ���ᣮ
��4����ѡ�â�Ϊ�������ռ�װ�ã�Ӧ�����Թܿڷ���һ������������Ӧ������������Һ��ʪ�������������չ�����������ֹ������Ⱦ��
��5����ѡ�â�Ϊ�����ռ�װ�ã�������Ӧ��A��ͨ�룮�û�ѧ�������������ռ����˵ķ�����ʪ��ĵ��۵⻯����ֽ
��6�������ж�����ѡ��ͨ������������Һ������β�������������ӷ���ʽΪ2OH-+Cl2=Cl-+ClO-+H2O��
���� ��1�����ݷ�Ӧ���״̬����Ӧ����ȷ����Ӧװ�ã��������̺�Ũ���ᷴӦ�����Ȼ��̡�������ˮ��ע��������̺�Ũ���ᷴӦ������ϡ���ᷴӦ��
��2�����������Ũ�����Ҫ���ȼ����Ʊ�������������Ӧ��Ԫ�ػ��ϼ۱仯������������ԭ��Ӧ��ʧ�����غ㡢ԭ�Ӹ����غ���ƽ����ʽ��
��3����ȡ�������к����Ȼ��⡢ˮ�������ʣ�����ͨ��ʢ�б���ʳ��ˮ��Ũ�����ϴ��ƿ��ȥ��
��4�������ж���ֱ���ŷ��ܹ����������Ⱦ�������ܹ���Ӧ����������������Һ���գ�
��5�������ܶȴ��ڿ����ܶȣ�Ӧѡ�������������ռ��������������������������������ɵ��ʵ⣻
��6�������ж���ֱ���ŷ��ܹ����������Ⱦ�������ܹ���Ӧ����������������Һ���գ����߷�Ӧ�����Ȼ��ơ��������ƺ�ˮ��
��� �⣺��1���������̺�Ũ����ķ�Ӧ�ǹ�Һ��ϼ����ͣ�����ѡ���װ�ã��ڼ��������£��������̺�Ũ���ᷴӦ�����Ȼ��̡�������ˮ��MnO2+4HC1��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnC12+C12��+2H2O��
�ʴ�Ϊ����MnO2+4HC1��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnC12+C12��+2H2O��
��2�����������Ũ�����Ҫ���ȼ����Ʊ�����������ѡ��װ�â��Ʊ�����Ӧ��KMnO4+��MnCl2��MnԪ�ػ��ϼ���+7����Ϊ+2��������5�ۣ�Cl��Ũ����Cl2��ClԪ�ػ��ϼ���-1������Ϊ0�ۣ�������Ϊ2�ۣ����ϼ�������С������Ϊ10����KMnO4��ϵ��Ϊ2��Cl2��ϵ��Ϊ5���ٸ���ԭ���غ���ƽ�������ʵ�ϵ������ƽ��ķ���ʽΪ��2KMnO4+16HCl��Ũ���T2KCl+2MnCl2+5Cl2��+8H2O�����ӷ���ʽΪ��2MnO4-+16H++10Cl-=2Mn2++5Cl2��+8H2O����
�ʴ�Ϊ����2��10��16��2��5��8H2O��
��3����ȡ�������к����Ȼ��⡢ˮ�������ʣ�����ͨ��ʢ�б���ʳ��ˮ��Ũ�����ϴ��ƿ��ȥ��
�ʴ�Ϊ����������ʳ��ˮ��Ũ���
��4�������ж���ֱ���ŷ��ܹ����������Ⱦ�������ܹ���Ӧ����������������Һ���գ�������ѡ�â�Ϊ�������ռ�װ�ã�Ӧ�����Թܿڷ���һ������������Ӧ������������Һ��ʪ�������������չ�����������ֹ������Ⱦ��
�ʴ�Ϊ������������Һ�����չ�����������ֹ������Ⱦ��
��5�������ܶȴ��ڿ����ܶȣ�Ӧѡ�������������ռ�����ѡ�â�Ϊ�����ռ�װ�ã�Ӧ�����̳�������A���룻�����������������������������ɵ��ʵ⣬���������۱��������Կ�����ʪ��ĵ��۵⻯����ֽ��
�ʴ�Ϊ��A��ʪ��ĵ��۵⻯����ֽ��
��6�������ж���ֱ���ŷ��ܹ����������Ⱦ�������ܹ���Ӧ����������������Һ���գ����߷�Ӧ�����Ȼ��ơ��������ƺ�ˮ�����ӷ���ʽ��2OH-+Cl2=Cl-+ClO-+H2O��
�ʴ�Ϊ���������ƣ�2OH-+Cl2=Cl-+ClO-+H2O��
���� ���⿼����������ʵ�����Ʊ�ԭ����װ��ѡ���ѶȲ�����Ϥ�����Ʊ�ԭ���������ǽ���ؼ���ע����ݷ�Ӧ���״̬����Ӧ����ѡ����Ӧ��װ�ã�

| A�� | ����Һ��Na2SO3�Ѳ�������? | |
| B�� | ����Ba��NO3��2��Һ���ɵij���һ����BaSO4? | |
| C�� | ��HCl��IJ��ܳ���һ��ΪBaSO4? | |
| D�� | ����Ʒδ������? |
| A�� | ���ڿ�����ȼ�յ��������ǹ������� | |
| B�� | ��ˮ��Ӧʱ�������ɼ������ | |
| C�� | �۷е���ԭ���������Ӷ����� | |
| D�� | ��������ʻ�ԭ����ԭ�ӵ��Ӳ��������Ӷ����� |
��֪�����ֽ��������������������������pH��Χ���±���ʾ����ʼ������pH����������Ũ��Ϊ1.0mol•L-1���㣩��
| ���� | ��ʼ������pH | ������ȫ��pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
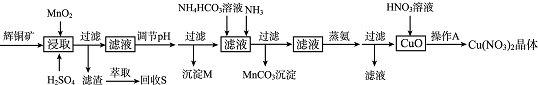
��1����ȡ��õ��Ľ���Һ�к���CuSO4��MnSO4��д����ȡʱ����CuSO4��MnSO4��Ӧ�Ļ�ѧ����ʽ2MnO2+Cu2S+4H2SO4=S��+2CuSO4+2MnSO4+4H2O��
��2������pH��Ŀ����������ת��������������ȫ������pH�ĵ��ڷ�ΧΪ3.2��pH��4.4��
��3������MnCO3���������ӷ���ʽΪMn2++NH3+HCO3-=MnCO3��+NH4+��
��4������AΪ����Ũ������ȴ�ᾧ��
��5���ɻ�ͭ����ȡͭ�ķ�Ӧ���̿��Ա�ʾΪ��
2Cu2S��s��+3O2 ��g��=2Cu2O��s��+2SO2��g����H=-768.2kJ•mol-l
2Cu2O��s��+Cu2S��s��=6Cu��s��+SO2��g����H=+116.0 kJ•mol-l
����Cu2S��O2���ȷ�Ӧ����Cu���Ȼ�ѧ����ʽΪCu2S��s��+02��g���T2Cu��s��+SO2��g����H=-217.4kJ��mol-l ��
��6�����ú�85% Cu2S�Ļ�ͭ�����Ʊ���ˮCu��NO3��2�������ȡ��Ϊ95%������pHʱ��ʧCu 3%��������������5%δת��ΪCuO����������������ģ���1.0kg�����Ļ�ͭ��������Ʊ�1.75kg��ˮCu��NO3��2��
| A�� | ���飾��ϩ����Ȳ | B�� | ��Ȳ����ϩ������ | C�� | ��ϩ�����飾��Ȳ | D�� | ����=��ϩ=��Ȳ |
| A�� | Na+��K+��HCO3-��NO3- | B�� | H+��Na+��Cl-�� | ||
| C�� | Fe3+��K+��S2-��Cl- | D�� | Cu2+��NO3-��Mg2+��SO42- |