题目内容
25g胆矾(CuSO4?5H2O)的物质的量为 ,其中含有 mol 氧原子,含有 个氢原子,含有硫元素的质量为 ,将此25g胆矾加热失去全部结晶水,得无水CuSO4的质量为 ,将此胆矾溶于水配成100ml溶液,则CuSO4的物质的量浓度为 .
考点:物质的量的相关计算,物质分子中的原子个数计算,物质的量浓度的相关计算
专题:阿伏加德罗常数和阿伏加德罗定律
分析:根据n=
计算胆矾物质的量,氧原子物质的量为胆矾的9倍,氢原子物质的量为胆矾的10倍,根据N=nNA计算氢原子数目,硫原子物质的量等于胆矾的物质的量,由硫酸根守恒,硫酸铜物质的量等于胆矾物质的量,根据m=nM计算硫元素、硫酸铜的质量,根据c=
计算CuSO4的物质的量浓度.
| m |
| M |
| n |
| V |
解答:
解:25g胆矾的物质的量为
=0.1mol,氧原子物质的量为0.1mol×9=0.9mol,含有氢原子数目为0.1mol×10×NAmol-1=NA,含有硫元素的质量为0.1mol×32g/mol=3.2g,由硫酸根守恒,硫酸铜物质的量等于胆矾物质的量,则硫酸铜的质量为0.1mol×160g/mol=16g,CuSO4的物质的量浓度为
=1mol/L,
故答案为:0.1;0.9;NA;3.2g;16g;1mol/L.
| 25g |
| 250g/mol |
| 0.1mol |
| 0.1L |
故答案为:0.1;0.9;NA;3.2g;16g;1mol/L.
点评:本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的计算.

练习册系列答案
相关题目
某工业生产中有一主要反应:CuFeS2+4Fe3+=5Fe2++Cu2++2S,其中CuFeS2中Cu为+2价.下列说法正确的是( )
| A、氧化剂为Fe3+,还原剂为Cu2+和S2+ |
| B、氧化产物是S,还原产物是Fe2+和Cu2+ |
| C、当转移1mol电子时,有46 g CuFeS2参加反应 |
| D、氧化剂的氧化性Fe3+>Fe2+>Cu2+ |
已知乙醇密度小于水,质量分数为96%的酒精溶液的物质的量浓度为16.6mol?L-1,试判断8.3mol?L-1的酒精溶液的溶质的质量分数为( )
| A、大于48% | B、等于48% |
| C、小于48% | D、无法确定 |
在一密闭容器里放入四种物质,使其在一定条件下充分反应,测得数据如下:则下列表述正确的是( )
| 四种物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量(g) | 25 | 15 | 1 | 5 |
| 反应后质量(g) | 11 | 未测 | 1 | 22 |
| A、该反应是复分解反应 |
| B、丙一定是催化剂 |
| C、乙全部发生了反应 |
| D、甲与乙反应的质量比为14:3 |
1mol O2在放电条件下发生下列反应:3O2
2O3,如有30%O2转化为O3,则放电后混合气体对H2的相对密度是( )
| ||
| A、17.8 | B、16 |
| C、18.4 | D、35.6 |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温下,23g NO2含有NA个氧原子 | ||
| B、0.1mol?L-1的烧碱溶液中含有0.1NA个Na + | ||
| C、22.4 L的CO气体与1 mol N2所含的分子数相等 | ||
D、9 g
|
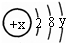 试回答:
试回答: