题目内容
短周期A、B、C、D 4种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上电子数之和.
(1)元素:A为 、B为 、C为 ,D的质子数和中子数相等,D 的原子组成符号为: ,它的最高价氧化物对应的水化物: ;(写化学式)
(2)用电子式表示A、B两元素形成AB2的过程: .
(1)元素:A为
(2)用电子式表示A、B两元素形成AB2的过程:
考点:位置结构性质的相互关系应用
专题:
分析:A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,则D为S元素,据此解答.
解答:
解:A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,则D为S元素.
(1)由上述分析可知,A为C元素、B为O元素、C为Na元素、D为S元素,D的质子数和中子数相等,D 的原子组成符号为:3216S,它的最高价氧化物对应的水化物:H2SO4,
故答案为:C;O;Na;3216S;H2SO4;
(2)A、B两元素形成的AB2为CO2,用电子式表示其形成过程为: ,
,
故答案为: .
.
(1)由上述分析可知,A为C元素、B为O元素、C为Na元素、D为S元素,D的质子数和中子数相等,D 的原子组成符号为:3216S,它的最高价氧化物对应的水化物:H2SO4,
故答案为:C;O;Na;3216S;H2SO4;
(2)A、B两元素形成的AB2为CO2,用电子式表示其形成过程为:
 ,
,故答案为:
 .
.
点评:本题考查结构性质位置关系应用,侧重对化学用语的考查,比较基础,注意理解掌握用电子式表示物质或化学键的形成.

练习册系列答案
相关题目
下列有关元素的性质及其递变规律正确的是( )
| A、同周期金属元素的化合价越高,其原子失电子能力越强 |
| B、第二周期元素从左到右,最高正价从+1递增到+7 |
| C、同主族元素的简单阴离子还原性越强,则该元素对应的气态氢化物稳定性越强 |
| D、IA族与 VIIA族元素间可形成共价化合物或离子化合物 |
下列反应的有机物中,同分异构体的数目最多是( )
| A、乙烷与Cl2在光照条件下发生取代反应 |
| B、分子式为C5H12O的醇被灼热的CuO氧化 |
| C、分子式为C4H8的烯烃与HCl在一定条件下发生加成反应 |
| D、分子式为C5H10O2的酸与分子式为C4H10O的醇发生酯化反应 |
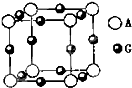 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外最外层电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外最外层电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q. A、B、C、D四种短周期元素,A、B为同周期元素,B、C同主族,B、C可形成共价化合物BC3和BC2,A、D同主族,A的原子结构示意图如图1,据此填空:
A、B、C、D四种短周期元素,A、B为同周期元素,B、C同主族,B、C可形成共价化合物BC3和BC2,A、D同主族,A的原子结构示意图如图1,据此填空:
 合成
合成 :
: