题目内容
 A、B、C、D四种短周期元素,A、B为同周期元素,B、C同主族,B、C可形成共价化合物BC3和BC2,A、D同主族,A的原子结构示意图如图1,据此填空:
A、B、C、D四种短周期元素,A、B为同周期元素,B、C同主族,B、C可形成共价化合物BC3和BC2,A、D同主族,A的原子结构示意图如图1,据此填空:(1)A的元素名称为
(2)A、B、C三种元素的原子,半径由小到大的顺序为
(3)A、B和D最高价氧化物对应的水化物,酸性由强到弱的顺序为
考点:位置结构性质的相互关系应用
专题:
分析:A、B、C、D四种短周期元素,A的原子结构示意图为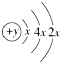 ,则x=2,所以A为硅元素,A、B为同周期元素,都是第三周期,B、C同主族,B、C可形成共价化合物BC3和BC2,则B为硫元素,C为氧元素,A、D同主族,且为短周期元素,所以D为碳元素,据此答题.
,则x=2,所以A为硅元素,A、B为同周期元素,都是第三周期,B、C同主族,B、C可形成共价化合物BC3和BC2,则B为硫元素,C为氧元素,A、D同主族,且为短周期元素,所以D为碳元素,据此答题.
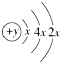 ,则x=2,所以A为硅元素,A、B为同周期元素,都是第三周期,B、C同主族,B、C可形成共价化合物BC3和BC2,则B为硫元素,C为氧元素,A、D同主族,且为短周期元素,所以D为碳元素,据此答题.
,则x=2,所以A为硅元素,A、B为同周期元素,都是第三周期,B、C同主族,B、C可形成共价化合物BC3和BC2,则B为硫元素,C为氧元素,A、D同主族,且为短周期元素,所以D为碳元素,据此答题.解答:
解:A、B、C、D四种短周期元素,A的原子结构示意图为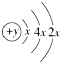 ,则x=2,所以A为硅元素,A、B为同周期元素,都是第三周期,B、C同主族,B、C可形成共价化合物BC3和BC2,则B为硫元素,C为氧元素,A、D同主族,且为短周期元素,所以D为碳元素.
,则x=2,所以A为硅元素,A、B为同周期元素,都是第三周期,B、C同主族,B、C可形成共价化合物BC3和BC2,则B为硫元素,C为氧元素,A、D同主族,且为短周期元素,所以D为碳元素.
(1)由上述分析可知,A为硅元素,故答案为:硅;
(2)A、B、C分别为Si、S、O,同周期自左而右原子半径减小、同主族自上而下原子半径增大,所以三种元素的原子半径由小到大的顺序为O<S<Si,
故答案为:O<S<Si;
(3)A、B和D最高价氧化物对应的水化物,分别为H2SiO3、H2SO4、H2CO3,非金属性越强,对应的最高价含氧酸的酸性就越强,所以它们的酸性由强到弱的顺序为:H2SO4>H2CO3>H2SiO3,若验证这三种酸的酸性强弱,根据强酸制弱酸的原理,则在装置中加入的试剂分别为:Ⅰ为H2SO4,Ⅱ为Na2CO3,Ⅲ为Na2SiO3,现象为:Ⅱ中有气泡生成,Ⅲ中出现白色胶状沉淀,Ⅲ中现象对应的离子方程式为:H2O+CO2+SiO32-=H2SiO3↓+CO32-,
故答案为:H2SO4>H2CO3>H2SiO3;H2SO4;Na2CO3;Na2SiO3;Ⅱ中有气泡生成,Ⅲ中出现白色胶状沉淀;H2O+CO2+SiO32-=H2SiO3↓+CO32-.
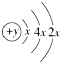 ,则x=2,所以A为硅元素,A、B为同周期元素,都是第三周期,B、C同主族,B、C可形成共价化合物BC3和BC2,则B为硫元素,C为氧元素,A、D同主族,且为短周期元素,所以D为碳元素.
,则x=2,所以A为硅元素,A、B为同周期元素,都是第三周期,B、C同主族,B、C可形成共价化合物BC3和BC2,则B为硫元素,C为氧元素,A、D同主族,且为短周期元素,所以D为碳元素.(1)由上述分析可知,A为硅元素,故答案为:硅;
(2)A、B、C分别为Si、S、O,同周期自左而右原子半径减小、同主族自上而下原子半径增大,所以三种元素的原子半径由小到大的顺序为O<S<Si,
故答案为:O<S<Si;
(3)A、B和D最高价氧化物对应的水化物,分别为H2SiO3、H2SO4、H2CO3,非金属性越强,对应的最高价含氧酸的酸性就越强,所以它们的酸性由强到弱的顺序为:H2SO4>H2CO3>H2SiO3,若验证这三种酸的酸性强弱,根据强酸制弱酸的原理,则在装置中加入的试剂分别为:Ⅰ为H2SO4,Ⅱ为Na2CO3,Ⅲ为Na2SiO3,现象为:Ⅱ中有气泡生成,Ⅲ中出现白色胶状沉淀,Ⅲ中现象对应的离子方程式为:H2O+CO2+SiO32-=H2SiO3↓+CO32-,
故答案为:H2SO4>H2CO3>H2SiO3;H2SO4;Na2CO3;Na2SiO3;Ⅱ中有气泡生成,Ⅲ中出现白色胶状沉淀;H2O+CO2+SiO32-=H2SiO3↓+CO32-.
点评:本题考查结构与位置关系、元素周期律、对化学实验原理理解等,注意理解掌握金属性、非金属性强弱比较实验事实.

练习册系列答案
相关题目
下列实验操作或装置(略去部分夹持仪器)正确的是( )
A、 乙酸乙酯的制备 |
B、 除去CO2中少量HCl |
C、 配制溶液 |
D、 中和热测定 |


