题目内容
(1)质量都是50g的HCl、NH3、CO2、O2四种气体中,含分子数最少的是 ;在同温同压下,密度最小的是 (填分子式).
(2)标准状况下,33.6LHCl气体溶于水配成1L溶液,则溶液中溶质的物质的量浓度为 mol/L.
(3)质量分数为49%的硫酸溶液,其密度为1.4g/cm3,则其物质的量浓度为 mol/L.
(4)有一种气体的质量是14.2g,在标准状况下的体积是4.48L,则该气体的摩尔质量为 g/mol.
(2)标准状况下,33.6LHCl气体溶于水配成1L溶液,则溶液中溶质的物质的量浓度为
(3)质量分数为49%的硫酸溶液,其密度为1.4g/cm3,则其物质的量浓度为
(4)有一种气体的质量是14.2g,在标准状况下的体积是4.48L,则该气体的摩尔质量为
考点:物质的量的相关计算
专题:计算题
分析:(1)由n=
可知,质量相等摩尔质量越大,物质的量越小,含有分子数目越少;同温同压下,气体的密度之比等于其摩尔质量之比;
(2)根据n=
计算HCl的物质的量,再根据c=
计算溶液物质的量浓度;
(3)根据c=
计算;
(4)根据n=
计算气体的物质的量,再根据M=
计算该气体的摩尔质量.
| m |
| M |
(2)根据n=
| V |
| Vm |
| n |
| V |
(3)根据c=
| 1000ρw |
| M |
(4)根据n=
| V |
| Vm |
| m |
| n |
解答:
解:(1)HCl、NH3、CO2、O2四种气体摩尔质量依次为36.5g/mol、17g/mol、44g/mol、32g/mol,
由n=
可知,质量相等摩尔质量越大,物质的量越小,含有分子数目越少,故含分子数最少的是CO2;
同温同压下,气体的密度之比等于其摩尔质量之比,故密度最小的是NH3,
故答案为:CO2;NH3;
(2)标况下,33.6LHCl的物质的量=
=1.5mol,溶于水配成1L溶液,溶液物质的量浓度=
=1.5mol/L,
故答案为:1.5;
(3)根据c=
可知,密度为1.4g/cm3,质量分数为49%的硫酸溶液的物质的量浓度=
mol/L=7mol/L,
故答案为:7;
(4)标况下,4.48L气体的物质的量=
=0.2mol,该气体的摩尔质量=
=71g/mol,
故答案为:71.
由n=
| m |
| M |
同温同压下,气体的密度之比等于其摩尔质量之比,故密度最小的是NH3,
故答案为:CO2;NH3;
(2)标况下,33.6LHCl的物质的量=
| 33.6L |
| 22.4L/mol |
| 1.5mol |
| 1L |
故答案为:1.5;
(3)根据c=
| 1000ρw |
| M |
| 1000×1.4×49% |
| 98 |
故答案为:7;
(4)标况下,4.48L气体的物质的量=
| 4.48L |
| 22.4L/mol |
| 14.2g |
| 0.2mol |
故答案为:71.
点评:本题考查处于化学计量的有关计算,比较基础,注意对公式的理解与灵活应用,注意掌握物质的量浓度与质量分数的关系.

练习册系列答案
相关题目
下列溶液中的C1-的物质的量浓度与150.0mL l.0mol/L CaCl2溶液中的Cl-物质的量浓度相等的是( )
| A、150.0mL 1.0 mol/L NaCl溶液 |
| B、75.0mL 2.0 mol/L MgCl2溶液 |
| C、150.0mL 2.0 mol/LKCl溶液 |
| D、75.0 mL 1.0 mol/L A1C13溶液 |
下列各组物质中,能用分液漏斗进行分离的是( )
| A、四氯化碳和液溴 |
| B、汽油和花生油 |
| C、苯和食盐水 |
| D、酒精和水 |
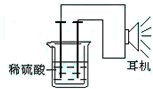 利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:
利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白: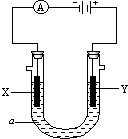 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: