题目内容
| A | |||||||||||||||||
| B | C | D | E | F | |||||||||||||
| G | H | I | |||||||||||||||
| a | b | c | d | ||||||||||||||
(A)a(B)b(C)c(D)d
(2)G元素与 E元素形成的化合物的化学式是
(3)①指出铁元素在元素周期表中的位置
②G、H两元素相比较,金属性较强的是
(a)看哪种原子失去的电子越多,金属性越强.
(b)比较这两种元素的单质的熔沸点
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性.
考点:元素周期表的结构及其应用,元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)a为ⅠA,包含非金属元素H;c为ⅤA族,d为ⅤⅡ族,均含非金属元素,只有b为ⅤⅡB,均为金属元素;
(2)G为Na、E为O,可形成氧化钠、过氧化钠,以上元素中,Na(G)的金属性最强,Al(H)的氢氧化物具有两性,Cl(I)的最高价氧化物对应的水化物酸性最强;
(3)①Fe的原子序数为26,原子结构中有4个电子层,最外层电子数为2;
②Na的金属性大于Al,可利用失去电子的难易、与水反应的剧烈程度等比较.
(2)G为Na、E为O,可形成氧化钠、过氧化钠,以上元素中,Na(G)的金属性最强,Al(H)的氢氧化物具有两性,Cl(I)的最高价氧化物对应的水化物酸性最强;
(3)①Fe的原子序数为26,原子结构中有4个电子层,最外层电子数为2;
②Na的金属性大于Al,可利用失去电子的难易、与水反应的剧烈程度等比较.
解答:
解:(1)a为ⅠA,c为ⅤA族,d为ⅤⅡ族,均含非金属元素,只有b为ⅤⅡB,均为金属元素,故答案为:b;
(2)G为Na、E为O,可形成氧化钠、过氧化钠,化学式分别为Na2O、Na2O2,均由离子构成,均属于离子化合物;九种元素的最高价氧化物对应的水化物中,碱性最强的是NaOH,其电子式为 ,酸性最强的是HClO4,属于两性氢氧化物的是Al(OH)3,
,酸性最强的是HClO4,属于两性氢氧化物的是Al(OH)3,
故答案为:Na2O;Na2O2;离子化合物; ;HClO4;Al(OH)3;
;HClO4;Al(OH)3;
(3)①Fe的原子序数为26,原子结构中有4个电子层,最外层电子数为2,位于第四周期Ⅷ族,故答案为:第四周期Ⅷ族;
②钠的金属性大于铝,只有将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液可比较金属性,而与失去电子的多少、物质熔点、氢化物无关,
故答案为:钠;(c).
(2)G为Na、E为O,可形成氧化钠、过氧化钠,化学式分别为Na2O、Na2O2,均由离子构成,均属于离子化合物;九种元素的最高价氧化物对应的水化物中,碱性最强的是NaOH,其电子式为
 ,酸性最强的是HClO4,属于两性氢氧化物的是Al(OH)3,
,酸性最强的是HClO4,属于两性氢氧化物的是Al(OH)3,故答案为:Na2O;Na2O2;离子化合物;
 ;HClO4;Al(OH)3;
;HClO4;Al(OH)3; (3)①Fe的原子序数为26,原子结构中有4个电子层,最外层电子数为2,位于第四周期Ⅷ族,故答案为:第四周期Ⅷ族;
②钠的金属性大于铝,只有将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液可比较金属性,而与失去电子的多少、物质熔点、氢化物无关,
故答案为:钠;(c).
点评:本题考查元素周期表的结构及应用,为高频考点,把握原子结构与元素位置、元素的性质为解答的关键,注重元素化合物性质的考查,题目难度不大.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、氢氧化钡与稀硫酸混合:SO42-+H++OH-+Ba2+=H2O+BaSO4↓ |
| B、碳酸氢钠溶液与NaOH溶液混合:HCO3-+OH-=H2O+CO32- |
| C、石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3↓ |
| D、氧化铜与盐酸反应 O2-+2H+=H2O |
 在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据:
在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据: 硫的化合物在生产和科研中发挥着重要作用.
硫的化合物在生产和科研中发挥着重要作用.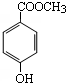 分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质在食品、化妆品等行业有广泛用途.
分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质在食品、化妆品等行业有广泛用途.