题目内容
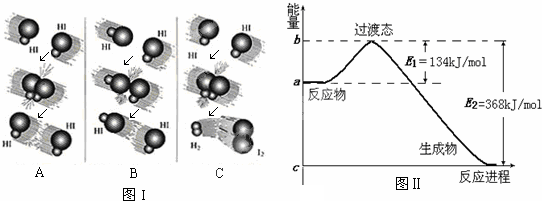
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
(1)③、④、⑤、⑥元素的原子半径由大到小的顺序为 ;
(2)在室温下有颜色的气体单质溶于水的离子方程式为 ;
(3)④元素形成的单质的电子式为 ;
(4)用电子式表示由⑦和⑨所组成化合物的形成过程 ;
(5)写出⑥和⑧最高价氧化物的水化物反应的离子方程式 .
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(2)在室温下有颜色的气体单质溶于水的离子方程式为
(3)④元素形成的单质的电子式为
(4)用电子式表示由⑦和⑨所组成化合物的形成过程
(5)写出⑥和⑧最高价氧化物的水化物反应的离子方程式
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)电子层越多半径越大,电子层一样多的原子,核电荷数越多半径越小;
(2)氯气溶于水会发生反应生成盐酸和次氯酸;
(3)氮气是含有氮氮三键的单质分子;
(4)氯化镁是镁离子和氯离子之间通过离子键形成的离子化合物;
(5)根据Na、Al的最高正价分别是+1、+3价来书写最高价氧化物对应水化物的分子式,氢氧化铝能和强碱之间反应.
(2)氯气溶于水会发生反应生成盐酸和次氯酸;
(3)氮气是含有氮氮三键的单质分子;
(4)氯化镁是镁离子和氯离子之间通过离子键形成的离子化合物;
(5)根据Na、Al的最高正价分别是+1、+3价来书写最高价氧化物对应水化物的分子式,氢氧化铝能和强碱之间反应.
解答:
解:根据元素在周期表中的分布,知道①~⑨代表的元素分别是H、Be、C、N、O、Na、Mg、Al、Cl,
(1)微粒半径大小比较方法:电子层越多半径越大,所以Na的半径最大,C、N、O电子层一样多的原子,核电荷数越多半径越小,即C>N>O,所以半径大小关系是:Na>C>N>O,故答案为:Na>C>N>O;
(2)氯气溶于水会发生反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2O?H++HClO+Cl-,故答案为:Cl2+H2O?H++HClO+Cl-;
(3)氮气是含有氮氮三键的单质分子,电子式为 ,故答案为:
,故答案为: ;
;
(4)氯化镁是镁离子和氯离子之间通过离子键形成的离子化合物,形成过程可以表示为 ,
,
故答案为: ;
;
(5)Na、Al的最高正价分别是+1、+3价,最高价氧化物对应水化物的分子式分别是NaOH和Al(OH)3,氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,该离子反应为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
(1)微粒半径大小比较方法:电子层越多半径越大,所以Na的半径最大,C、N、O电子层一样多的原子,核电荷数越多半径越小,即C>N>O,所以半径大小关系是:Na>C>N>O,故答案为:Na>C>N>O;
(2)氯气溶于水会发生反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2O?H++HClO+Cl-,故答案为:Cl2+H2O?H++HClO+Cl-;
(3)氮气是含有氮氮三键的单质分子,电子式为
 ,故答案为:
,故答案为: ;
;(4)氯化镁是镁离子和氯离子之间通过离子键形成的离子化合物,形成过程可以表示为
 ,
,故答案为:
 ;
;(5)Na、Al的最高正价分别是+1、+3价,最高价氧化物对应水化物的分子式分别是NaOH和Al(OH)3,氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,该离子反应为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评:本题考查学生元素周期表的结构和元素周期律知识,属于综合知识的考查,难度较大.

练习册系列答案
相关题目
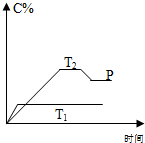 在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
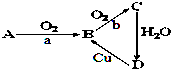 如图为A、B、C、D四种物质的转化关系,a、b为反应条件,
如图为A、B、C、D四种物质的转化关系,a、b为反应条件,