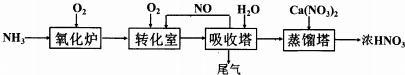
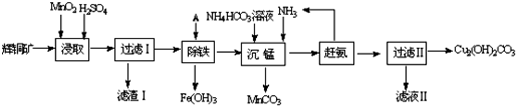
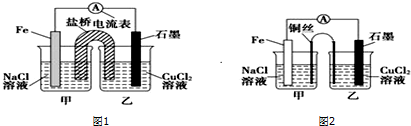
题目内容
3.下列关于滴定操作的叙述,正确的是( )| A. | 在中和滴定实验中,锥形瓶须用待测液润洗 | |
| B. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| C. | 用标准盐酸溶液滴定未知浓度NaOH溶液时,若滴定前滴定管尖嘴处有气泡未排出而滴定后消失,则能使所测结果偏高 | |
| D. | 滴定时可将KMnO4溶液装在碱式滴定管中 |
分析 A、盛装待测液的锥形瓶不能使用待测液润洗,否则待测液的物质的量偏大;
B、广泛pH试纸精确到整数;
C、根据C(待测)=$\frac{C(标准)×V(标准)}{V(待测)}$判断不当操作对V(标准)的影响;
D、KMnO4溶液具有强氧化性,能腐蚀碱式滴定管中的橡胶管;
解答 解:A、行酸碱中和滴定实验时,盛装待测液的锥形瓶使用前应先用待测液润洗,会导致待测液的物质的量偏大,形成误差,故A错误;
B、广泛pH试纸测得溶液的pH值应是整数,故B错误;
C、滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失,导致V(标准)偏大,C(待测)=$\frac{C(标准)×V(标准)}{V(待测)}$可知,沉淀结果偏高,故C正确;
D、KMnO4溶液具有强氧化性,能够氧化橡胶管,所以必须使用酸式滴定管量取,故D错误;
故选C.
点评 本题考查了酸碱中和滴定的误差分析以及仪器、试纸的使用,试题基础性强,难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练.

练习册系列答案
相关题目
4.下列说法或实验操作正确的是( )
| A. | 容量瓶、量筒和滴定管上都标有使用温度,容量瓶无“0”刻度,量筒、滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 向3支试管中各加入2mL 0.1mol•L-1酸性高锰酸钾溶液和2mL 0.01mol•L-1 H2C2O4溶液,将它们分别置于冰水、室温下、80℃热水中,观察比较褪色快慢 | |
| C. | 皂化反应结束后的混合液中加入饱和食盐水,再通过分液操作分离出硬脂酸钠 | |
| D. | 为保证实验安全,金属钠切割下来的表层物质应放回原试剂瓶,不能在研钵中研磨氯酸钾或硝酸钾 |
5.常温下,下列溶液中微粒的物质的量浓度关系一定正确的是( )
| A. | NaHCO3溶液中:c(H+)+c(H2CO3)=2c(CO32-)+c(OH-) | |
| B. | 向0.1 mol•L-1的NH4Cl溶液中通入一定量的NH3后:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 向CH3COOH溶液中滴加NaOH使pH>7溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 0.3 mol•L-1的 HY溶液与0.3 mol•L-1的NaOH溶液等体积混合后所得pH=9的溶液中:c(OH-)-c(HY)=c(H+)=1×10-9 mol•L-1 |
2.下列分子式表示物质种类最多的是( )
| A. | C4H8 | B. | C5H12O | C. | C5H11Br | D. | 酯C5H10O2 |
9.水的电离平衡曲线如图所示.下列说法正确的是( )
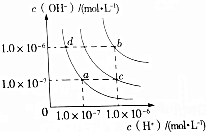

| A. | a点对应温度条件下,将pH=x的氨水稀释10倍后,其pH=y,则x=y+1 | |
| B. | 纯水仅升高温度,可从d点变到b点 | |
| C. | c点对应温度条件下醋酸的电离常数比a点对应温度条件下醋酸的电离常数大 | |
| D. | b点对应温度条件下,0.5mol•L-1的H2SO4溶液与1mol•L-1的KOH溶液等体积混合,充分反应后,所得溶液的c(H+)=10-7mol•L-1 |
13.化学在生产和日常生活中有着重要的作用,下列有关说法不正确的是( )
| A. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液均具有丁达尔效应 | |
| C. | 12月2日我国发射的“嫦娥三号”卫星中使用的碳纤维,是一种新型无机非金属材料 | |
| D. | 只要符合限量,“食用色素”、“碘元素”、“亚硝酸盐”可以作为某些食品的添加剂 |