题目内容
17.白黎芦醇 广泛存在于食物(如桑椹、花生、尤其是葡萄)中,它可能具有抗癌作用.1mol该物质和Br2、H2分别反应,消耗Br2、H2的物质的量最多为( )
广泛存在于食物(如桑椹、花生、尤其是葡萄)中,它可能具有抗癌作用.1mol该物质和Br2、H2分别反应,消耗Br2、H2的物质的量最多为( )| A. | 1 mol,1 mol | B. | 3.5 mol,7 mol | C. | 3.5 mol,6 mol | D. | 6 mol,7 mol |
分析 藜芦醇含有的官能团有酚羟基、碳碳双键,酚羟基的邻、对位能与溴发生取代反应,碳碳双键能和溴发生加成反应;苯环和碳碳双键能与氢气发生加成反应,据此计算Br2和H2的最大用量.
解答 解:白藜芦醇含有的官能团3个酚羟基,共有5个邻位氢原子可被溴发生取代,含有1个碳碳双键能和溴发生加成反应,则1mol白藜芦醇与溴水发生取代反应需要溴5mol,碳碳双键与溴发生加成反应需溴1mol,所以共需要溴6mol;
1mol白藜芦醇含有2mol苯环和1mol碳碳双键,2mol苯环与氢气加成需要6mol氢气,1mol碳碳双键与氢气加成需要1mol氢气,所以1mol白藜芦醇与氢气发生加成反应一共需要7mol氢气.
故选:D.
点评 本题考查有机物的官能团及其结构,为高频考点,侧重于学生的分析能力的考查,难度不大,注意酚的取代反应位置是羟基的邻、对位,间位不能发生取代反应.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
7.已知酸性  >H2CO3>
>H2CO3> >HCO3-,现要将
>HCO3-,现要将  转变为
转变为 ,可行的方法是( )
,可行的方法是( )
 >H2CO3>
>H2CO3> >HCO3-,现要将
>HCO3-,现要将  转变为
转变为 ,可行的方法是( )
,可行的方法是( )| A. | 与足量NaOH溶液共热,再通入足量HCl | |
| B. | 与稀硫酸共热后,加入足量的 NaOH | |
| C. | 与足量NaOH溶液共热,再通入足量的CO2 | |
| D. | 加稀硫酸共热后,再加入足量Na2CO3溶液 |
5.Cl2、漂白液(有效成分为NaClO)在生产、生活中广泛用于杀菌、消毒.
(1)电解NaCl溶液生成Cl2的化学方程式是2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
(2)①Cl2溶于H2O、NaOH溶液即获得氯水、漂白液.
干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是HClO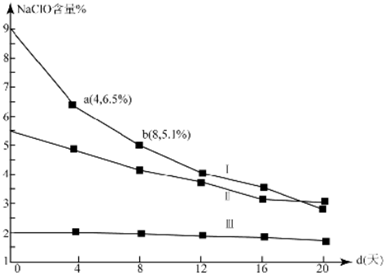
②25℃,Cl2与H2O、NaOH的反应如下:
不直接使用氯水而使用漂白液做消毒剂的原因是K2>K1,反应Ⅱ的有效成分比反应Ⅰ的有效成分大,氯气转化为HClO更充分,次氯酸钠比次氯酸更稳定
(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为:Fe-2e-=Fe2+:ClO-发生的电极反应式是ClO-+2e-+H2O=Cl-+2OH-
(4)研究漂白液的稳定性对其生产和保存有实际意义.30℃时,pH=11的漂白液中NaClO的质量百分含量随时间变化如下:
①分解速v(Ⅰ)、v(Ⅱ)的大小关系是>,原因是在相同条件下,次氯酸钠的浓度越大,其分解速率越大
②NaClO分解的化学方程式是2NaClO$\frac{\underline{\;30℃\;}}{\;}$2NaCl+O2↑
③4d~8d,Ⅰ中v(NaClO)=0.047mol/(L.d)(常温下漂白液的密度约为1g/cm3,且变化忽略不计)
(1)电解NaCl溶液生成Cl2的化学方程式是2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
(2)①Cl2溶于H2O、NaOH溶液即获得氯水、漂白液.
干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是HClO

②25℃,Cl2与H2O、NaOH的反应如下:
| 反应Ⅰ | Cl2+H2O?Cl-+H++HClO K1=4.5×10-4 |
| 反应Ⅱ | Cl2+2OH-?Cl-+ClO-+H2O K2=7.5×1015 |
(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为:Fe-2e-=Fe2+:ClO-发生的电极反应式是ClO-+2e-+H2O=Cl-+2OH-
(4)研究漂白液的稳定性对其生产和保存有实际意义.30℃时,pH=11的漂白液中NaClO的质量百分含量随时间变化如下:
①分解速v(Ⅰ)、v(Ⅱ)的大小关系是>,原因是在相同条件下,次氯酸钠的浓度越大,其分解速率越大
②NaClO分解的化学方程式是2NaClO$\frac{\underline{\;30℃\;}}{\;}$2NaCl+O2↑
③4d~8d,Ⅰ中v(NaClO)=0.047mol/(L.d)(常温下漂白液的密度约为1g/cm3,且变化忽略不计)
12.某气态烃0.5mol能与1molHCl完全加成,加成后产物分子上的氢原子又可被3molCl2取代,则此气态烃可能是?( )
| A. | 丙炔 | B. | 乙烯 | C. | 乙炔 | D. | 丁烯? |
2.下列说法中正确的是( )
| A. | PCl3分子是三角锥形,这是因为磷原子是sp2杂化的结果 | |
| B. | 乙烯分子中的碳氢键是氢原子的1s轨道和碳原子的一个个sp3杂化轨道形成的 | |
| C. | 中心原子采取sp3杂化的分子,其几何构型可能是四面体形或三角锥形或V形 | |
| D. | AB3型的分子空间构型必为平面三角形 |
9.某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子.在agHmX中所含质子的物质的量是( )
| A. | $\frac{a}{A(A-N+m)mol}$ | B. | $\frac{a}{A}$(A-N) mol | C. | $\frac{a}{A+m}$(A-N) mol | D. | $\frac{a}{A+m}$(A-N+m) mol |