题目内容
9.某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子.在agHmX中所含质子的物质的量是( )| A. | $\frac{a}{A(A-N+m)mol}$ | B. | $\frac{a}{A}$(A-N) mol | C. | $\frac{a}{A+m}$(A-N) mol | D. | $\frac{a}{A+m}$(A-N+m) mol |
分析 根据质子数=质量数-中子数计算X原子质子数,进而计算每个HmX分子含有质子数,根据n=$\frac{m}{M}$计算HmX的物质的量,结合每个分子含有质子数计算.
解答 解:某元素的一种同位素X的原子质量数为A,含N个中子,则质子数为(A-N),则每个HmX分子含有质子数为(A-N+m),ag HmX的物质的量为$\frac{ag}{(m+A)g/mol}$=$\frac{a}{(m+A)}$mol,故含有质子物质的量为$\frac{a}{(m+A)}$mol×(A-N+m)=$\frac{a}{A+m}$(A-N+m) mol,故选D.
点评 本题考查物质的量有关计算、原子结构,比较基础,属于字母型计算,一定程度上增大计算难度.

练习册系列答案
相关题目
19.已知编号为①~⑧的短周期八种元素的某些性质如下表所示:
请根据已学过的元素周期表的性质,确定以上8种元素在周期表中的位置,并将元素的编号填入下表中:
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | ||||||||
| 3 |
17.白黎芦醇 广泛存在于食物(如桑椹、花生、尤其是葡萄)中,它可能具有抗癌作用.1mol该物质和Br2、H2分别反应,消耗Br2、H2的物质的量最多为( )
广泛存在于食物(如桑椹、花生、尤其是葡萄)中,它可能具有抗癌作用.1mol该物质和Br2、H2分别反应,消耗Br2、H2的物质的量最多为( )
 广泛存在于食物(如桑椹、花生、尤其是葡萄)中,它可能具有抗癌作用.1mol该物质和Br2、H2分别反应,消耗Br2、H2的物质的量最多为( )
广泛存在于食物(如桑椹、花生、尤其是葡萄)中,它可能具有抗癌作用.1mol该物质和Br2、H2分别反应,消耗Br2、H2的物质的量最多为( )| A. | 1 mol,1 mol | B. | 3.5 mol,7 mol | C. | 3.5 mol,6 mol | D. | 6 mol,7 mol |
14.在氯化钠晶体中,若1个Na+周围平均分布着1.5个37Cl-,则平均分布着的35Cl-数为( )
| A. | 4.5个 | B. | 4个 | C. | 10.5个 | D. | 1个 |
19.25℃时,弱酸的电离平衡常数如表:下列有关说法正确的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-8 | 4.9×10-10 | K1;4.3×10-7 K2:5.6×10-11 |
| A. | 等物质的量浓度的各溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | a mol/L HCN与b mol/L NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b | |
| C. | 往冰醋酸中逐滴加水,溶液导电能力先增大,后减小 | |
| D. | NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
 ,
,
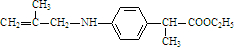 .
.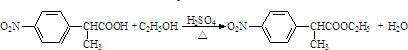 .
.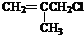 有相同官能团的同分异构体有10种.(要求考虑顺反异构)
有相同官能团的同分异构体有10种.(要求考虑顺反异构)
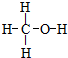 .
.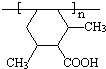 .
. .
. .
. .
.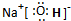 ,这种化合物中所含的化学键类型有离子键、共价键.
,这种化合物中所含的化学键类型有离子键、共价键.