题目内容
2.下列说法中正确的是( )| A. | PCl3分子是三角锥形,这是因为磷原子是sp2杂化的结果 | |
| B. | 乙烯分子中的碳氢键是氢原子的1s轨道和碳原子的一个个sp3杂化轨道形成的 | |
| C. | 中心原子采取sp3杂化的分子,其几何构型可能是四面体形或三角锥形或V形 | |
| D. | AB3型的分子空间构型必为平面三角形 |
分析 A、根据杂化轨道数等于孤电子对数加上成键电子对数;
B、乙烯分子中的碳氢键是氢原子的1s轨道和碳原子的一个sp2杂化轨道形成的重叠,形成4个C-Hσ键;
C、通过sp3杂化形成中性分子,价层电子对个数是4且不含孤电子对,如CH4或CF4,分子为正四面体结构,分子中价层电子对个数是4且含有一个孤电子对,为三角锥型分子,该类型分子有NH3或NF3,该分子中价层电子对个数是4且具有2个孤电子对,为V型分子如H2O;
D、根据中心原子A周围有无孤电子对,来分析判断.
解答 解:A、PCl3分子中磷原子孤电子对数为1,成键电子对数为3,杂化轨道数为:1+3=4,所以磷原子是sp3杂化,故A错误;
B、乙烯分子中的碳氢键是氢原子的1s轨道和碳原子的一个sp2杂化轨道形成的重叠,形成4个C-Hσ键,故B错误;
C、通过sp3杂化形成中性分子,为正四面体、三角锥型、V型结构,故C正确;
D、如果中心原子A周围无孤电子对,则分子的空间构型为平面三角形,故D错误;
故选C.
点评 本题考查了分子的空间构型的判断、杂化方式的判断等知识点,注意乙烯分子中4个C-H化学键如何形成,比较容易.

练习册系列答案
相关题目
12.下列关于砷(As)元素的叙述中,正确的是( )
| A. | 在AsCl5分子中,各原子最外层都达到了8电子稳定结构 | |
| B. | 砷的相对原子质量为74.92,由此可知砷原子核内有42个中子 | |
| C. | 砷的氢化物的化学式为AsH3,它是一种强氧化剂 | |
| D. | Na3AsO4溶液的pH大于7 |
10.下列各项中,表达正确的是( )
| A. | 乙醛的结构简式:CH3COH | B. | C2H2分子的结构式:CH≡CH | ||
| C. | CH4分子的比例模型: | D. | 异丁烷的键线式: |
17.白黎芦醇 广泛存在于食物(如桑椹、花生、尤其是葡萄)中,它可能具有抗癌作用.1mol该物质和Br2、H2分别反应,消耗Br2、H2的物质的量最多为( )
广泛存在于食物(如桑椹、花生、尤其是葡萄)中,它可能具有抗癌作用.1mol该物质和Br2、H2分别反应,消耗Br2、H2的物质的量最多为( )
 广泛存在于食物(如桑椹、花生、尤其是葡萄)中,它可能具有抗癌作用.1mol该物质和Br2、H2分别反应,消耗Br2、H2的物质的量最多为( )
广泛存在于食物(如桑椹、花生、尤其是葡萄)中,它可能具有抗癌作用.1mol该物质和Br2、H2分别反应,消耗Br2、H2的物质的量最多为( )| A. | 1 mol,1 mol | B. | 3.5 mol,7 mol | C. | 3.5 mol,6 mol | D. | 6 mol,7 mol |
7.下列有关元素周期表的说法中正确的是( )
| A. | 元素周期表有18个族 | |
| B. | 第IA族元素称为碱金属元素 | |
| C. | 原子最外层电子数相同的元素,一定属于同一族 | |
| D. | 第3列至第12列的元素全为金属元素 |
14.在氯化钠晶体中,若1个Na+周围平均分布着1.5个37Cl-,则平均分布着的35Cl-数为( )
| A. | 4.5个 | B. | 4个 | C. | 10.5个 | D. | 1个 |
11.1mol 丙烯与Cl2完全发生加成反应后,再与Cl2彻底取代,两过程共消耗Cl2的物质的量为( )
| A. | 4mol | B. | 5mol | C. | 6mol | D. | 7mol |
12.下列电子式正确的是( )
| A. |  | B. |  | ||
| C. | 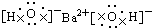 | D. |  |

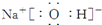 或
或 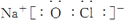 .
.