题目内容
8.周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时离子数之比为1:2.写出这些化合物的化学式Na2O、MgF2、CaCl2、K2S.分析 周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时离子数之比为1:2,二者能形成离子化合物,如果化合物中非金属化合价为-1价,金属化合价为+2价,非金属位于第VIIA族、金属位于第IIA族,如果金属化合价为+1价、则非金属化合价为-2价,则金属元素位于第IA族、非金属元素位于第VIA族,据此分析解答.
解答 解:周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时离子数之比为1:2,二者能形成离子化合物,如果化合物中非金属化合价为-1价,金属化合价为+2价,非金属位于第VIIA族、金属位于第IIA族,如果金属化合价为+1价、则非金属化合价为-2价,则金属元素位于第IA族、非金属元素位于第VIA族,
如果金属位于第IA族、非金属位于第VIA族,如果金属是Na元素,某两种元素的原子序数相差3,周期数相差1,则非金属为O元素,其化合物是Na2O,如果金属元素是K元素,则非金属元素是S元素,形成的化合物是K2S;
如果金属元素位于第II族、非金属元素位于第VIIA族,如果金属是Mg元素,某两种元素的原子序数相差3,周期数相差1,则非金属是F元素,二者形成的化合物是 MgF2,如果金属元素是Ca元素,则非金属元素是Cl元素,二者形成的化合物是CaCl2,
故答案为:Na2O、MgF2、CaCl2、K2S.
点评 本题考查原子结构和元素性质,为高考高频点,侧重考查学生对周期表结构、原子结构、物质结构的认识,同时还考查学生发散思维能力,注意题干中没有明确“1:2”中哪种是阳离子、哪种是阴离子,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.下列说法正确的是( )
| A. | 饱和NH4Cl溶液中:c(H+)+c(Cl-)=c(NH4+)+2c(NH3•H2O)+c(OH-) | |
| B. | 将AlCl3溶液和Na2SO3溶液分别蒸干并灼烧,得到Al2O3和Na2SO3 | |
| C. | 25℃,若10mLpH=a的盐酸与100mLpH=b 的Ba(OH)2溶液混合恰好中和,则a+b=14 | |
| D. | 25℃,Ka (HF)=3.6×10-4,Ka(CH3COOH)=1.75×10-5,0.1mol/L 的NaF溶液与0.1mol/L 的CH3COOK溶液相比:c(Na+)-c(F-)>c(K+)-c(CH3COO-) |
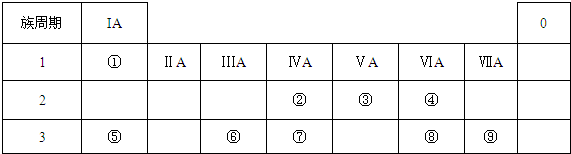
19.已知编号为①~⑧的短周期八种元素的某些性质如下表所示:
请根据已学过的元素周期表的性质,确定以上8种元素在周期表中的位置,并将元素的编号填入下表中:
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | ||||||||
| 3 |
16.下列说法错误的是( )
| A. | 苯环的碳碳键键长都相等 | |
| B. | 苯分子中各个键角都是120° | |
| C. | 一个苯分子中含有三个碳碳单键三个碳碳双键 | |
| D. | 常温下苯是一种不溶于水且密度小于水的液体 |
3.下列说法正确的是( )
| A. | 物质发生化学变化都伴随着能量变化 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量可能相同 | |
| D. | 在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 |
17.白黎芦醇 广泛存在于食物(如桑椹、花生、尤其是葡萄)中,它可能具有抗癌作用.1mol该物质和Br2、H2分别反应,消耗Br2、H2的物质的量最多为( )
广泛存在于食物(如桑椹、花生、尤其是葡萄)中,它可能具有抗癌作用.1mol该物质和Br2、H2分别反应,消耗Br2、H2的物质的量最多为( )
 广泛存在于食物(如桑椹、花生、尤其是葡萄)中,它可能具有抗癌作用.1mol该物质和Br2、H2分别反应,消耗Br2、H2的物质的量最多为( )
广泛存在于食物(如桑椹、花生、尤其是葡萄)中,它可能具有抗癌作用.1mol该物质和Br2、H2分别反应,消耗Br2、H2的物质的量最多为( )| A. | 1 mol,1 mol | B. | 3.5 mol,7 mol | C. | 3.5 mol,6 mol | D. | 6 mol,7 mol |

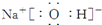 或
或 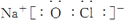 .
. ,
, .
.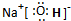 ,这种化合物中所含的化学键类型有离子键、共价键.
,这种化合物中所含的化学键类型有离子键、共价键.