题目内容
5.Cl2、漂白液(有效成分为NaClO)在生产、生活中广泛用于杀菌、消毒.(1)电解NaCl溶液生成Cl2的化学方程式是2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
(2)①Cl2溶于H2O、NaOH溶液即获得氯水、漂白液.
干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是HClO
②25℃,Cl2与H2O、NaOH的反应如下:
| 反应Ⅰ | Cl2+H2O?Cl-+H++HClO K1=4.5×10-4 |
| 反应Ⅱ | Cl2+2OH-?Cl-+ClO-+H2O K2=7.5×1015 |
(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为:Fe-2e-=Fe2+:ClO-发生的电极反应式是ClO-+2e-+H2O=Cl-+2OH-
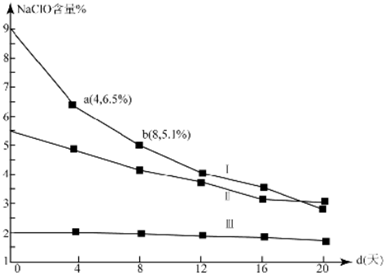
(4)研究漂白液的稳定性对其生产和保存有实际意义.30℃时,pH=11的漂白液中NaClO的质量百分含量随时间变化如下:
①分解速v(Ⅰ)、v(Ⅱ)的大小关系是>,原因是在相同条件下,次氯酸钠的浓度越大,其分解速率越大
②NaClO分解的化学方程式是2NaClO$\frac{\underline{\;30℃\;}}{\;}$2NaCl+O2↑
③4d~8d,Ⅰ中v(NaClO)=0.047mol/(L.d)(常温下漂白液的密度约为1g/cm3,且变化忽略不计)
分析 (1)电解NaCl溶液可生成氢气、氯气和氢氧化钠;
(2)对比氯水的成分可知具有漂白性的物质;氯水中HClO浓度较低,且不稳定;
(3)ClO-得电子被还原;
(4)①一般来说浓度越大,反应速率越大;
②NaClO分解的最终产物为NaCl和氧气;
③4d~8d,NaClO的含量由6.5%变为5.1%,假设溶液体积为1L,计算NaClO的消耗的量,进而计算速率.
解答 解:(1)电解NaCl溶液可生成氢气、氯气和氢氧化钠,方程式为2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$ 2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$ 2NaOH+H2↑+Cl2↑;
(2)①氯水中含有盐酸和次氯酸,氯气和盐酸都不具有漂白性,具有漂白性的为HClO,故答案为:HClO;
②氯水和漂白液的漂白成分为HClO,根据平衡常数K2>K1,确定漂白液的有效成分次氯酸更多,并且次氯酸钠比次氯酸更稳定,
故答案为:K2>K1,反应Ⅱ的有效成分比反应Ⅰ的有效成分大,氯气转化为HClO更充分,次氯酸钠比次氯酸更稳定;
(3)Fe-2e-=Fe2+应为负极反应,则正极反应为ClO-得电子被还原,方程式为ClO-+2e-+H2O=Cl-+2OH-,故答案为:ClO-+2e-+H2O=Cl-+2OH-;
(4)①根据图可知次氯酸钠的其实含量Ⅰ大于Ⅱ,浓度越大反应速率越大,则v(Ⅰ)>v(Ⅱ),
故答案为:>;在相同条件下,次氯酸钠的浓度越大,其分解速率越大;
②NaClO分解的最终产物为NaCl和氧气,方程式为2NaClO$\frac{\underline{\;30℃\;}}{\;}$2NaCl+O2↑,故答案为:2NaClO$\frac{\underline{\;30℃\;}}{\;}$2NaCl+O2↑;
③4d~8d,NaClO的含量由6.5%变为5.1%,假设溶液体积为1L,v(NaClO)=[(6.5%-5.1%)×1g/mL×103÷74.5g/mol]÷4d=0.047mol/(L.d),故答案为:0.047.
点评 本题为生活、生产实际相关的综合题,主要考查的是对元素化合物、化学动力学等当面的知识,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,难度中等.

①
 ②
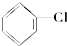
②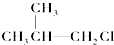 ③(CH3)3C-CH2Cl④CHCl2-CHBr2⑤
③(CH3)3C-CH2Cl④CHCl2-CHBr2⑤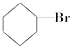 ⑥CH3Cl.
⑥CH3Cl.| A. | ①③⑥ | B. | ②③⑤ | C. | 全部 | D. | ②④ |
| A. | 苯环的碳碳键键长都相等 | |
| B. | 苯分子中各个键角都是120° | |
| C. | 一个苯分子中含有三个碳碳单键三个碳碳双键 | |
| D. | 常温下苯是一种不溶于水且密度小于水的液体 |
| A. | 乙醛的结构简式:CH3COH | B. | C2H2分子的结构式:CH≡CH | ||
| C. | CH4分子的比例模型: | D. | 异丁烷的键线式: |
 广泛存在于食物(如桑椹、花生、尤其是葡萄)中,它可能具有抗癌作用.1mol该物质和Br2、H2分别反应,消耗Br2、H2的物质的量最多为( )
广泛存在于食物(如桑椹、花生、尤其是葡萄)中,它可能具有抗癌作用.1mol该物质和Br2、H2分别反应,消耗Br2、H2的物质的量最多为( )| A. | 1 mol,1 mol | B. | 3.5 mol,7 mol | C. | 3.5 mol,6 mol | D. | 6 mol,7 mol |
| A. | 4.5个 | B. | 4个 | C. | 10.5个 | D. | 1个 |
| A. | 0.1 mol聚乙烯含有的原子数目为0.6NA | |
| B. | 一定条件下,26 g乙炔、苯和苯乙烯的气态混合物中所含碳原子数为2NA | |
| C. | 1 mol甲基含10 NA个电子 | |
| D. | 标准状况下,22.4L CHCl3中所含有的原子总数为5NA |

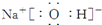 或
或 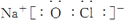 .
. ,
,