题目内容
5.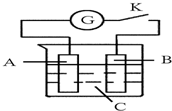 如图所示,把A、B插入C的溶液中,闭合电键K后电流计G的指针会发生偏转,且B上有气泡产生,则A、B、C三种物质可能是( )
如图所示,把A、B插入C的溶液中,闭合电键K后电流计G的指针会发生偏转,且B上有气泡产生,则A、B、C三种物质可能是( )| A. | A是Cu、B是Zn、C是CuSO4溶液 | B. | A是Cu、B是Cu、C是H2SO4溶液 | ||
| C. | A是Zn、B是石墨、C是稀H2SO4溶液 | D. | A是石墨、B是Zn、C是CuSO4溶液 |
分析 由图及信息可知,G的指针会发生偏转,且B上有气泡产生,结合选项可知,发生金属与酸的电池反应,则A为排在H前面的金属,B为H后面的金属或惰性电池,电解质为硫酸或盐酸等,以此来解答.
解答 解:A.Zn比Cu活泼,发生Zn与硫酸铜的电池反应,则B溶解,不能生成气体,故A不选;
B.Cu与稀硫酸不反应,且两个电极相同,不能构成原电池,故B不选;
C.Zn为负极,石墨为正极,发生Zn与稀硫酸的电池反应,形成原电池,且B上有气泡产生,故C选;
D.Zn为负极,发生Zn与硫酸铜的电池反应,则B溶解,不能生成气体,故D不选;
故选C.
点评 本题考查原电池,为高频考点,把握原电池中电极判断、电极反应与现象等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
5.下列各组离子能大量共存的是( )
| A. | 向溶液中通入氯气:Ca2+、CH3COO-、Br-、Na+ | |
| B. | 碱性溶液:Na+、SO42-、Cl-、ClO- | |
| C. | 加入浓盐酸的溶液:Fe2+、K+、NO3-、NH4+ | |
| D. | 由水电离出的c(H+)=1×10-12的溶液:K+、Ca2+、Br-、HCO3- |
20.下列说法正确的是( )
| A. | 将28.6 g Na2CO3•10H2O溶于100 mL蒸馏水中,可以配成100 mL 1.0 mol/L Na2CO3溶液 | |
| B. | 可以用重结晶法除去KNO3固体中混杂的NaCl,这是因为NaCl在水中的溶解度很大 | |
| C. | 用润湿的pH试纸测稀酸溶液的pH,测定值偏小 | |
| D. | 金属Mg与CO2和稀硫酸均能反应,其反应类型相同 |
14.下列各组元素中,第一电离能大小次序不正确的是( )
| A. | Mg>Al | B. | S<P | C. | K<Cs | D. | Br<Cl |
15.在某密闭容器中,通入一定量的NO2,发生反应:2NO2(g)?N2O4(g)△H<0.下列叙述中正确的是( )
| A. | 恒温恒容,达平衡后再充入N2O4气体,NO2百分含量变小 | |
| B. | 增大压强,平衡向正反应方向移动,混合气体颜色变浅 | |
| C. | 达平衡后,升高温度,△H减小 | |
| D. | 2v正(NO2)═v逆(N2O4)说明反应达到化学平衡状态 |
 BCl3是重要的化工原料,其沸点12℃.500℃时,向2L的密闭容器中按一定比例投入B2O3、C、Cl2,模拟工业制取三氯化硼的反应如下:B2O3(s)+3C(s)+3Cl2(g)?2BCl3 (g)+3CO(g).
BCl3是重要的化工原料,其沸点12℃.500℃时,向2L的密闭容器中按一定比例投入B2O3、C、Cl2,模拟工业制取三氯化硼的反应如下:B2O3(s)+3C(s)+3Cl2(g)?2BCl3 (g)+3CO(g).