题目内容
W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素.Y和W的最外层电子数相等.Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍.由此可知:
(1)写出元素名称:W为 ,X为 ,Y为 ,Z为 .
(2)X2的电子式为 ,W2X2的结构式为 .
(3)由Y、X、W组成的物质的电子式为 ,它是有 键和 键组成的 化合物.
(4)W2Z和W2X相比:沸点更高的是 (填化学式),原因是 ;稳定性更强的是 (填化学式),原因是 .
(1)写出元素名称:W为
(2)X2的电子式为
(3)由Y、X、W组成的物质的电子式为
(4)W2Z和W2X相比:沸点更高的是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期的金属只有Li、Be、Na、Mg、Al,Y和W的最外层电子数相等即W和Y同族,所以W只能是H(氢),因不存在稀有气体,所以如果Y是Li,X就成了稀有气体,不成立,所以Y是Na,Y的质子数是11,Z一定大于Y,也就是12以上,故Y和Z的和能被3整除的数有:24、27,故Z质子数为:24-11=13,或27-11=16,W的质子数是1,X的质子数有可能是7或8,故W、Z、Y、Z分别为:1,7,11,13(铝为另一种金属)不成立,或1,8,11,16 成立,所以W、X、Y、Z分别为:H、O、Na、S,据此解答.
解答:
解:短周期的金属只有Li、Be、Na、Mg、Al,Y和W的最外层电子数相等即W和Y同族,所以W只能是H(氢),因不存在稀有气体,所以如果Y是Li,X就成了稀有气体,不成立,所以Y是Na,Y的质子数是11,Z一定大于Y,也就是12以上,故Y和Z的和能被3整除的数有:24、27,故Z质子数为:24-11=13,或27-11=16,W的质子数是1,X的质子数有可能是7或8,故W、Z、Y、Z分别为:1,7,11,13(铝为另一种金属)不成立,或1,8,11,16 成立,所以W、X、Y、Z分别为:H、O、Na、S,
(1)通过以上分析知,W、X、Y、Z分别为氢、氧、钠、硫,
故答案为:氢;氧;钠;硫;
(2)X是O元素,氧分子中两个氧原子之间共用两对电子,所以O2的电子式为 ,H2O2分子中H原子和O原子之间共用一对电子、O原子之间共用一对电子,所以双氧水分子结构式为H-O-O-H,
,H2O2分子中H原子和O原子之间共用一对电子、O原子之间共用一对电子,所以双氧水分子结构式为H-O-O-H,
故答案为: ;H-O-O-H;
;H-O-O-H;
(3)由Y、X、W组成的物质为NaOH,NaOH中存在离子键和共价键,所以为离子化合物,其电子式为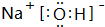 ,
,
故答案为: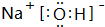 ;离子;共价键;离子;
;离子;共价键;离子;
(4)H2O和H2S都是分子晶体,但水中存在氢键、硫化氢中不存在氢键,所以水的沸点大于硫化氢,
元素的非金属性越强,其氢化物越稳定,非金属性O>S,所以稳定性更强的是H2O,
故答案为:H2O;水分子间存在氢键 (H2S分子间只有范德华力,氢键的作用力强于范德华力);
H2O;水分子中氢氧键的键能大于H2S分子中氢硫键的键能(氧的非金属性大于硫).
(1)通过以上分析知,W、X、Y、Z分别为氢、氧、钠、硫,
故答案为:氢;氧;钠;硫;
(2)X是O元素,氧分子中两个氧原子之间共用两对电子,所以O2的电子式为
 ,H2O2分子中H原子和O原子之间共用一对电子、O原子之间共用一对电子,所以双氧水分子结构式为H-O-O-H,
,H2O2分子中H原子和O原子之间共用一对电子、O原子之间共用一对电子,所以双氧水分子结构式为H-O-O-H,故答案为:
 ;H-O-O-H;
;H-O-O-H;(3)由Y、X、W组成的物质为NaOH,NaOH中存在离子键和共价键,所以为离子化合物,其电子式为
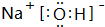 ,
,故答案为:
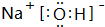 ;离子;共价键;离子;
;离子;共价键;离子;(4)H2O和H2S都是分子晶体,但水中存在氢键、硫化氢中不存在氢键,所以水的沸点大于硫化氢,
元素的非金属性越强,其氢化物越稳定,非金属性O>S,所以稳定性更强的是H2O,
故答案为:H2O;水分子间存在氢键 (H2S分子间只有范德华力,氢键的作用力强于范德华力);
H2O;水分子中氢氧键的键能大于H2S分子中氢硫键的键能(氧的非金属性大于硫).
点评:本题考查位置结构性质的相互关系及应用,涉及化学用语、物质结构等知识点,侧重考查学生对基本理论、基本用语的掌握,知道氢键只影响物理性质不影响化学性质,氢键大于分子间作用力而小于化学键,题目难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
下列有关原电池的说法中正确的是( )
| A、原电池是把电能转化为化学能的装置 |
| B、在内电路中,电子由正极流向负极 |
| C、原电池工作时,正极表面一定有气泡产生 |
| D、原电池工作时,可能会伴随着热量变化 |
某强氧化剂RO3中R元素能被还原成较低的价态,如果还原2.4×10-3 mol RO3-需要6×10-3 mol Na2SO3(Na2SO3转化成Na2SO4),则反应后R元素的价态是( )
| A、0 | B、+1 | C、+3 | D、+4 |
无机化学命名委员会(国际组织)在1989年作出决定,把长式元素周期表原先的主、副族 及族号取消,由左到右改为18列,如碱金属族为第1列,稀有气体元素为第18列.按此规定,下列说法中错误的是( )
| A、第17、18列都是非金属元素 |
| B、第1列元素和第17列元素的单质熔、沸点变化趋势相反 |
| C、只有第2列元素原子最外层有2个电子 |
| D、在18列元素中,第3列元素种类最多 |
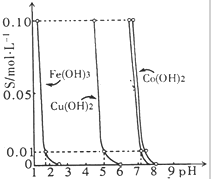 如图所示的是25℃时,Fe(OH)3、Cu(OH)2、Co(OH)2等物质在不同pH下的溶解性(c为溶液中阳离子的物质的量浓度).
如图所示的是25℃时,Fe(OH)3、Cu(OH)2、Co(OH)2等物质在不同pH下的溶解性(c为溶液中阳离子的物质的量浓度).