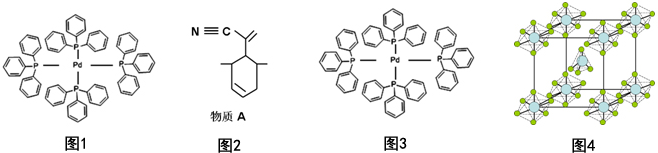
题目内容
4.下列现象与氢键有关的是( )①HF的水溶液是弱酸,而其它卤族元素形成的氢化物水溶液是强酸
②乙醇可以和水以任意比互溶
③冰的密度比液态水的密度小
④水分子高温下也很稳定
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低.
| A. | ②③④⑤ | B. | ①②③⑤ | C. | ①②③④ | D. | ①②③④⑤ |
分析 ①HF的水溶液是弱酸,而氢溴酸、氢碘酸和氢氯酸都是强酸;
②乙醇和水分子间形成氢键;
③冰中含有氢键,其体积变大;
④氧元素非金属性强;
⑤对羟基苯甲酸易形成分子之间氢键.
解答 解:①HF的水溶液是弱酸,而氢溴酸、氢碘酸和氢氯酸都是强酸,所以其它卤族元素形成的氢化物水溶液是强酸,而氢氟酸与氢氟酸分子间由于氢键形成缔合物,故正确;
②乙醇和水分子间形成氢键,所以乙醇可以和水以任意比互溶,故正确;
③冰中含有氢键,其体积变大,所以冰的密度比液态水的密度小,故正确;
④氧元素非金属性强,与氢键无关,故错误;
⑤对羟基苯甲酸易形成分子之间氢键,所以邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低,故正确;
故选B.
点评 本题考查氢键及氢键对物质的性质的影响,明确氢键主要影响物质的物理性质是解答本题的关键,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
14.下列各组离子能在溶液中大量共存的是( )
| A. | K+、Na+、Cl-、NO3- | B. | Fe3+、K+、Br-、SCN- | ||
| C. | NH4+、Na+、CO32-、OH- | D. | Al3+、Mg2+、SO42-、HCO3- |
15.下列说法或表示正确的是( )
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由单质A转化为单质B时△H=+119 kJ/mol 可知单质B比单质A稳定 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含l mol NaOH的溶液混合,放出的热量大于57.3kJ | |
| D. | 在101kPa时,H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,则H2在101kPa时的燃烧热为571.6kJ/mol |
12.铁钉和碳棒用导线连接,浸入稀NaCl溶液中,正极发生的反应是( )
| A. | 2H++2e-═H2↑ | B. | 2H2O+O2+4e-═4OH- | ||
| C. | Fe-2e-═Fe2+ | D. | 4OH--4e-═2H2O+O2↑ |
9.下列关于物质用途的说法中,不正确的是( )
| A. | Fe2O3可以做油漆的颜料 | B. | Al2O3可用作耐火材料 | ||
| C. | 铝合金比纯铝的熔点更高 | D. | 赤铁矿可用作炼铁的原料 |
16.将SO2通入BaCl2溶液至饱和,未见沉淀,继续通入某气体仍无沉淀,则该气体可能是( )
| A. | Cl2 | B. | NH3 | C. | NO2 | D. | CO2 |
13.下列各组中的反应,属于同一反应类型的是( )
| A. | 1-丙醇制丙烯;丙烯与溴水反应制1,2-二溴丙烷 | |
| B. | 溴乙烷水解制丙醇;丙烯与水反应制丙醇 | |
| C. | 甲苯硝化制对硝基甲苯;甲苯氧化制苯甲酸 | |
| D. | 乙酸和乙醇制乙酸乙酯;苯甲酸乙酯水解制苯甲酸和乙醇 |
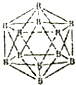 晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图).若其中有两个原子为10B,其余为11B,则该结构单元结构类型有( )
晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图).若其中有两个原子为10B,其余为11B,则该结构单元结构类型有( ) .
.