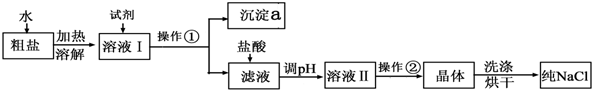
题目内容
18.反应X(g)+Y(g)?2Z(g)△H<0,达到平衡时,下列说法正确的是( )| A. | 增大压强,平衡向右移动 | B. | 加入催化剂,Z的产率增大 | ||
| C. | 增大c(X),X的转化率增大 | D. | 降低温度,Y的转化率增大 |
分析 反应X(g)+Y(g)?2Z(g)△H<0,反应前后气体的计量数之和相等,则增大压强、加入催化剂等平衡移动,正反应放热,升高温度,平衡逆向移动,以此解答该题.
解答 解:A.反应前后气体的计量数之和相等,则增大压强平衡不移动,故A错误;
B.加入催化剂,平衡不移动,故B错误;
C.增大c(X),平衡正向移动,但X转化较少,X的转化率反而减小,故C错误;
D.正反应放热,降低温度,平衡正向移动,Y的转化率增大,故D正确.
故选D.
点评 本题考查化学平衡及图象,为高频考点,侧重于学生的分析能力的考查,注意把握反应的特征,难度不大.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
8.下列离子方程式正确的是( )
| A. | 碳酸的电离:H2CO3═2H++HCO3- | |
| B. | 将金属钠加入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 硫化钠水解:S2-+2H2O?H2S↑+2OH- | |
| D. | 向氯化铝溶液中加入过量的烧碱溶液:Al3++3OH-═Al(OH)3↓ |
6.已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,则下列叙述中正确的是( )
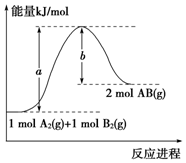

| A. | 每生成2分子AB吸收b kJ热量 | |
| B. | 该反应过程的活化能为b kJ•mol-1 | |
| C. | 断裂1 mol A-A和1 mol B-B键,放出a kJ能量 | |
| D. | 该反应的反应热△H=+(a-b) kJ•mol-1 |
3.下列各组离子能在溶液中大量共存的是( )
| A. | Ag+、K+、NO3-、Cl- | B. | Mg2+、Na+、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、OH-、Cl- | D. | H+、Na+、CO32-、SO42- |
1.一定温度下,在三个体积均为0.5L的恒容密闭容器中发生反应:CO(g)+Cl2(g)?COCl2(g),其中容器Ⅰ中5min时到达平衡.
下列说法中正确的是( )
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| CO | Cl2 | COCl2 | COCl2 | ||
| Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
| Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
| Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
| A. | 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol•L-1•min-1 | |
| B. | 该反应正反应为吸热反应 | |
| C. | 容器Ⅱ中起始时Cl2的物质的量为0.55 mol | |
| D. | 若起始时向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO转化率小于80% |
2.在100℃时,将0.40mol NO2气体充入2L的密闭容器中,发生如下反应:2NO2(g)?N2O4(g)△H<0.监测反应获得如表数据:下列说法正确的是( )
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| A. | 0~20 s内,v(NO2)=0.005 mol•L-1•s-1 | |
| B. | 59 s时,c(NO2)一定大于0.12 mol•L-1 | |
| C. | 若仅将起始时充入NO2的量增至0.80 mol,则该反应的平衡常数K>$\frac{25}{9}$ | |
| D. | 若上述反应在120℃时进行,则反应至80 s时,n(N2O4)<0.08 mol |