题目内容
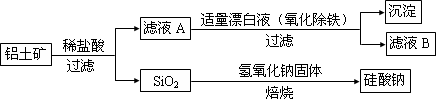
某同学设计了以下流程来检验碳酸钠粉末中可能含有少量氯化钠和氢氧化钠中的一种或两种杂质。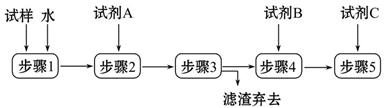
(1)步骤1所需玻璃仪器是______;步骤3的操作名称是______。
(2)对检验碳酸钠粉末中可能含有的杂质提出合理假设:
假设1:只含有氯化钠;
假设2:只含有___________;
假设3:氯化钠和氢氧化钠都含有。
(3)设计实验方案,进行实验。
限选以下试剂:氯化钡溶液、硝酸钡溶液、酚酞试液、稀硝酸、稀盐酸、稀硫酸、硝酸银溶液。回答下列问题:
①加入过量试剂A的名称是______。
②填写下表:
| 实验步骤 | 预期现象和结论 |
| 步骤4: | |
| 步骤5: | |
(1)烧杯、玻璃棒 过滤
(2)氢氧化钠 (3)①硝酸钡溶液
②实验步骤 预期现象和结论 步骤4:取少量滤液于试管,往其中滴加2~3滴酚酞试液 ①如果酚酞变红,假设2或假设3成立。
②如果酚酞不变红,假设1成立。步骤5:用试管取少量滤液, 往其中滴加足量的稀硝酸至溶液呈酸性,再滴加硝酸银溶液 ①若没有白色沉淀生成,则说明假设2成立。
②若有白色沉淀生成,则说明假设1或假设3成立;结合步骤4①如果酚酞变红,假设3成立。
解析

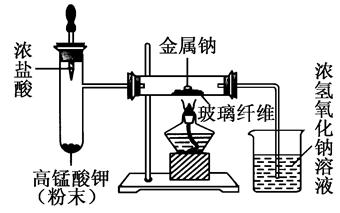
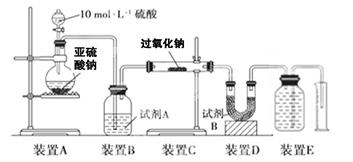
(16分)某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).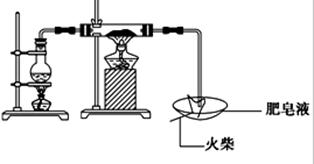
(1)如何检查该装置的气密性:
(2)写出铁与水蒸气反应的化学方程式
(3)验证固体产物中铁元素的价态
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;1mol/L CuSO4、3mol/L H2SO4、3mol/L HNO3、30%H2O2、0.01mol/L KMnO4、20%KSCN、蒸馏水。
在答题卡上按下表的格式写出实验步骤、预期现象与结论。
| | 实验步骤 | 预期现象与结论 |
| 步骤1 | 取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的 ,振荡溶解,过滤后将滤液配成250mL溶液,待用。 | |
| 步骤2 | 取少量步骤1中滤液于试管中, | |
| 步骤3 | 取少量步骤1中滤液于试管中, | |
(4)固体产物中铁元素的质量分数的测定可采用下图的流程
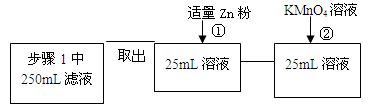
其中步骤①是向溶液中加入锌粉至黄色刚好消失;步骤②用0.010 mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液平均为v mL。(已知5Fe2++MnO4- +8H+==5Fe3++Mn2++4H2O)
其中加入锌粉的目的是____ ____。
实验测得ag样品中固体产物铁元素的质量分数为____ __ _(只列计算表达式)。
某探究小组采用下图所示装置进行Fe粉与水蒸气的反应。
(1)实验前检查装置气密性的方法为________________________________________________________。
(2)检验实验中生成气体的实验操作是_____________________________________________。
(3)将探究小组分为两组,按题图装置进行对比实验,甲组用酒精喷灯、乙组用酒精灯加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,无气泡 |
| 2 | 取步骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①乙组得到的黑色粉末是 。
②甲组步骤1中反应的离子方程式为 。
③乙组步骤4中,溶液变红的原因为 ;溶液褪色可能的原因是 ;验证方法为 。