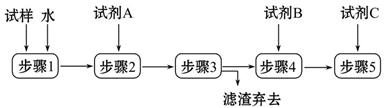
题目内容
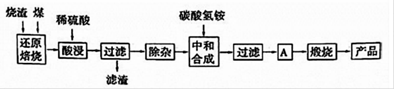
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。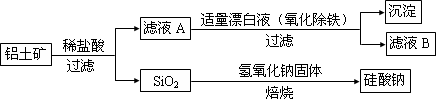
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
②检验滤液A中是否含有Fe2+的试剂是 ,其实验现象为 。
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。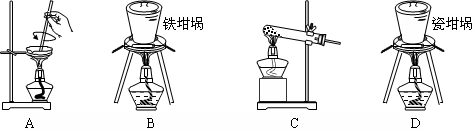
(1)①取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素。(其他合理答案均得分)
②酸性KMnO4 滴入的酸性KMnO4的紫红色褪去(其他合理答案均得分)
③过滤
(2)B
解析试题解析:(1)①滤液B中铁元素的存在形式为Fe3+和Fe2+,所以检验是否还有铁元素也即检验是否还有Fe3+和Fe2+,因此取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素。
②滤液A中含有Fe3+和Fe2+,检验Fe2+的存在需选择和Fe2+反应而不和Fe3+反应的试剂且现象明显,例如,酸性KMnO4溶液,溴水等。
③滴加浓盐酸目的是在加热过程中防止氯化铝水解,冷却结晶后得氯化铝的晶体,过滤可得。
(2)蒸发皿、玻璃试管、瓷坩埚中均含有SiO2,易与NaOH反应,所以制备硅酸钠应选择铁坩埚,答案选B。
考点:考查铝、硅化合物在工业生产中的应用以及铁元素的检验

在实验室测定碳酸钠与碳酸氢钠的混合物中,碳酸钠的质量分数[用符号w(Na2CO3)表示],称取此混合物5.lg,溶于水中,配成250mL溶液。
a.(10分)方案一:沉淀法测w(Na2CO3)利用化学反应把HCO3-、CO32-完全转化为沉淀,称取沉淀的质量,由此计算混合物中w (Na2CO3)。
(1)量取100 mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选的试剂是___________ (填编号)。
| A.CaCl2 | B.MgSO4 | C..NaCI | D.Ba(OH)2 |
(3)过滤,提取沉淀,则过滤操作所需要的玻璃仪器有________________________。
(4)洗涤沉淀,简述洗涤沉淀的操作_____________________________。
(5)干燥充分,称取沉淀的质量为9.8g,由此计算w(Na2CO3)。如果此步中,沉淀未干燥充分就称量,则测得w (Na2CO3)________________(填偏大或偏小、无影响)。
b.方案二:滴定法测w(Na2CO3)量取25.00 mL配制好的溶液加入锥形瓶中,滴加2滴酚酞试剂,摇匀,用0.2000 mol/L的盐酸进行滴定到终点。重复此操作2次,消耗盐酸的体积平均值为20.00 mL。 [已知饱和的碳酸溶液PH为3.9]
(1)量取25.00 mL配制好的溶液,应选择_______________仪器来完成。
(2)判断滴定终点的依据是_____________________,此过程中反应的离子方程式为__________________________________________________。
(3)此法测得w(Na2CO3)=________%(保留两位小数)
为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题: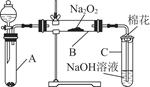
(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃,甲同学因此认为SO2与Na2O2的反应不同于CO2。请按甲同学的观点写出反应的化学方程式 。
(2)乙同学认为无论反应原理如何,最终都有O2产生,乙同学的理由是 。按照乙同学的观点,该装置需做的改进是
。
(3)假设Na2O2完全反应,反应后B装置中固体生成物可能是:①Na2SO3;②Na2SO4;③Na2SO3和Na2SO4。
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成下表:
限选试剂:2 mol·L-1 HCl溶液,1 mol·L-1 HNO3溶液,1 mol·L-1 BaCl溶液,1 mol·L-1 Ba(NO3)2溶液,0.01 mol·L-1 KMnO4酸性溶液。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中 | 固体完全溶解 |
| 步骤2:往Ⅰ试管中加入 ,再滴加 | , |
| 则证明生成物中含Na2SO4 | |
| 步骤3:往Ⅱ试管中 | |
| | 若 , |
| 则证明生成物中有Na2SO3;若 | |
| | |
| 则说明生成物中没有Na2SO3。 | |
(4)生成物中亚硫酸钠含量的测定:
①取a g生成物配制成100 mL溶液,取10.00 mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,用0.010 0 mol·L-1碘水进行滴定,滴定终点现象为 。记录数据,重复滴定2次,平均消耗碘水20.00 mL。
②计算:生成物中亚硫酸钠的质量分数为 。
我国化工专家侯德榜发明的侯氏制碱法的化学原理是将二氧化碳通入氨水的氯化钠饱和溶液中,其化学反应方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。
(1)在实验室中利用上述原理从反应所得溶液中分离出碳酸氢钠晶体,应选用下列装置中的 。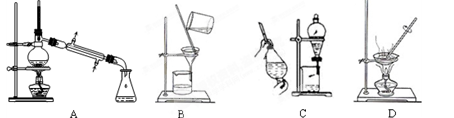
(2)实验所得碳酸氢钠晶体中,可能含有的杂质离子有Cl—和NH4+,实验室鉴定Cl—所选用的试剂是、,鉴定另一种杂质离子的方法是 (填序号)。
| A.加水,将湿润的红色石蕊试纸放在试管口 |
| B.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口 |
| C.加氢氧化钠溶液,加热,滴入酚酞试剂 |
| D.加氢氧化钠溶液,加热,滴入紫色石蕊试剂 |
 含量将下降,其原因是 (用离子方程式表示)?
含量将下降,其原因是 (用离子方程式表示)?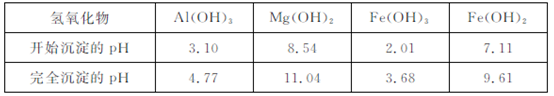
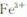 和
和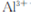 ,溶液的pH最大值应小于 ,常温下,当
,溶液的pH最大值应小于 ,常温下,当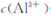 =
= 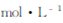 (已知常温下
(已知常温下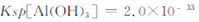 )?
)?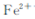 转变为碳酸亚铁沉淀,则A的操作是 ?
转变为碳酸亚铁沉淀,则A的操作是 ?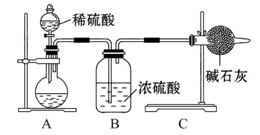

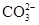 沉淀完全,能否使用氯化钙溶液代替氯化钡溶液?_______ (填“能”或“否”),原因是:_____________________________________。
沉淀完全,能否使用氯化钙溶液代替氯化钡溶液?_______ (填“能”或“否”),原因是:_____________________________________。 样品含有少量
样品含有少量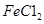 杂质。现要测定其中
杂质。现要测定其中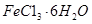 的质量分数,实验按以下步骤进行:
的质量分数,实验按以下步骤进行: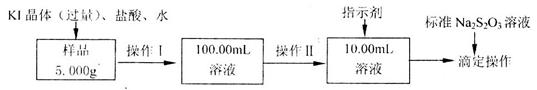
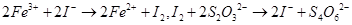
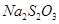 溶液18.00mL。该样品中
溶液18.00mL。该样品中