题目内容
室温下,等体积的、pH=2的 HCl和CH3COOH溶液,以下说法正确的是( )
| A、两溶液中由水电离的c(H+)前者小于后者 |
| B、两溶液分别和足量的锌反应,生成氢气的体积相等 |
| C、两溶液分别和相同的锌反应,生成氢气的起始速率相等 |
| D、两溶液分别和与其体积相等的、pH=12的NaOH溶液混合后,都呈中性 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:A、酸溶液分析水的电离,计算溶液中氢氧根的浓度,pH=2的 HCl和CH3COOH溶液中氢氧根浓度均为10-12mol/L,两溶液中由水电离的c(H+)相等;
B、等体积的、pH=2的 HCl和CH3COOH溶液分别跟足量的镁充分反应,醋酸为弱酸,其浓度大,醋酸的物质的量大,反应生成的氢气体积大;
C、pH=2的 HCl和CH3COOH溶液起始氢离子浓度相同,两溶液分别和相同的锌反应,生成氢气的起始速率相等;
D、两溶液分别和与其体积相等的、pH=12的NaOH溶液混合后,盐酸恰好完全反应,溶液呈中性,醋酸过量,溶液呈酸性.
B、等体积的、pH=2的 HCl和CH3COOH溶液分别跟足量的镁充分反应,醋酸为弱酸,其浓度大,醋酸的物质的量大,反应生成的氢气体积大;
C、pH=2的 HCl和CH3COOH溶液起始氢离子浓度相同,两溶液分别和相同的锌反应,生成氢气的起始速率相等;
D、两溶液分别和与其体积相等的、pH=12的NaOH溶液混合后,盐酸恰好完全反应,溶液呈中性,醋酸过量,溶液呈酸性.
解答:
解:A、pH=2的 HCl和CH3COOH溶液中氢氧根浓度均为10-12mol/L,两溶液中由水电离的c(H+)相等,故A错误;
B、等体积的、pH=2的 HCl和CH3COOH溶液分别跟足量的镁充分反应,醋酸为弱酸,其浓度大,醋酸的物质的量大,反应生成的氢气体积大,故B错误;
C、pH=2的 HCl和CH3COOH溶液起始氢离子浓度相同,两溶液分别和相同的锌反应,生成氢气的起始速率相等,故C正确;
D、两溶液分别和与其体积相等的、pH=12的NaOH溶液混合后,盐酸恰好完全反应,溶液呈中性,醋酸过量,溶液呈酸性,故D错误.
故选:C;
B、等体积的、pH=2的 HCl和CH3COOH溶液分别跟足量的镁充分反应,醋酸为弱酸,其浓度大,醋酸的物质的量大,反应生成的氢气体积大,故B错误;
C、pH=2的 HCl和CH3COOH溶液起始氢离子浓度相同,两溶液分别和相同的锌反应,生成氢气的起始速率相等,故C正确;
D、两溶液分别和与其体积相等的、pH=12的NaOH溶液混合后,盐酸恰好完全反应,溶液呈中性,醋酸过量,溶液呈酸性,故D错误.
故选:C;
点评:本题考查弱电解质的电离,关键注意与强电解质的比较,综合考查学生的分析能力和元素化合物知识的应用能力,为高考常见题型,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述正确的是( )
| A、浓度均为0.1mol?L-1的小苏打溶液与烧碱溶液等体积混合c(Na+)+c(H+)=2c(CO32-)+c(OH-) |
| B、某二元酸(H2A)在水中的电离方程式是:H2A=H++HA-,HA-?H++A2-;则NaHA溶液中:c(Na+)=c(A2-)+c(HA-)+c(H2A) |
| C、pH=12的氨水溶液与pH=2的盐酸溶液等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、常温下,10mLpH=12的Ba(OH)2溶液与40mLcmol?-1的NaHSO4溶液混合,当溶液中的Ba2+、SO42-均恰好完全沉淀,若混合后溶液的体积为50mL,则溶液pH=11 |
某无色溶液中加入过量盐酸有沉淀产生,过滤后向滤液中加入过量氨水又有沉淀产生,下列溶液中符合条件的是( )
| A、Ag+、Al3+、Fe3+ |
| B、SiO32-、[Al(OH)4]-、K+ |
| C、Ag+、Cu2+、Na+ |
| D、Ag+、Ba2+、Na+ |
 用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g)?CH3OH(g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g)?CH3OH(g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )| A、正反应速率:v(a)>v(c) v(b)>v(d) | ||||||||
| B、平衡时a点一定有n(CO):n(H2)=1:2 | ||||||||
| C、平衡常数:K(a)>K(c) K(b)=K(d) | ||||||||
D、平均摩尔质量:
|
若向略含少量水蒸气的容器中通入SO2与H2S共1mol,充分反应后,所得的氧化产物比还原产物多8g,则通入SO2和H2S的物质的量之比可能是( )
| A、1:5 | B、1:2 |
| C、2:1 | D、1:3 |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢或锂电池的十倍,可连续使用一个月才充一次电,其电池反应为:2CH3OH+3O2H-=2CO32-+6H2O,则下列有关说法不正确的是( )
| A、放电时化学能转变为电能 |
| B、放电时CH3OH参与正极反应 |
| C、充电时阴极产CH3OH |
| D、充电时每生成1molCH3OH,则转移6mol电子 |
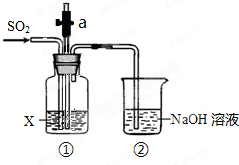 某同学用如图所示装置探究SO2的性质.
某同学用如图所示装置探究SO2的性质.